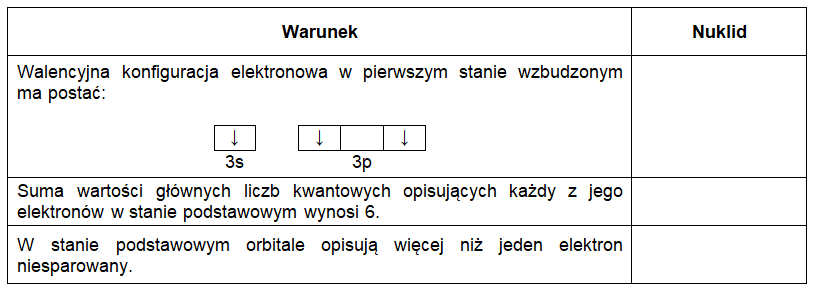
Kwas azotowy(III) jest związkiem trwałym jedynie w bardzo rozcieńczonych roztworach. Dlatego, jeśli wprowadzi się stężony kwas siarkowy(VI) do wodnego roztworu azotanu(III) potasu o dostatecznie wysokim stężeniu, wówczas kwas azotowy(III) praktycznie nie powstanie. Obserwuje się wtedy wydzielanie bezbarwnego, bezwonnego gazu, który brunatnieje u wylotu naczynia reakcyjnego. Drugim produktem opisanej przemiany chemicznej jest woda, a kolejnym – kwas, w cząsteczkach którego azot przyjmuje maksymalny stopień utlenienia. Bezwodnikiem kwasu azotowego(III) jest nietrwały tlenek N2O3, który rozkłada się z utworzeniem dwóch opisanych wcześniej substancji gazowych. Po osiągnięciu stanu równowagi w temperaturze pokojowej T, faza gazowa może zawierać wtedy 50% objętościowych związku N2O3.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
W celu ustalenia charakteru chemicznego tlenków – bezbarwnego oraz powstałego z niego tlenku brunatnego przeprowadzono pewne doświadczenie chemiczne. W tym celu przygotowano dwie serie probówek. W każdej z tych serii znajdowały się następujące mieszaniny:
– wodny roztwór KOH z dodatkiem kilku kropli roztworu oranżu metylowego,
– woda dejonizowana z dodatkiem kilku kropli roztworu oranżu metylowego,
– wodny roztwór KOH z dodatkiem kilku kropli alkoholowego roztworu fenoloftaleiny.
Do zawartości każdego wymienionych naczyń wprowadzono opisane tlenki (po jednym do probówek znajdujących się w każdej serii), przy czym w przypadku tlenku bezbarwnego doświadczenie przeprowadzono w układach praktycznie pozbawionych tlenu. Podczas przebiegu tego doświadczenia wykonano kilka fotografii. Cztery z nich zamieszczono poniżej:

Brunatny tlenek został użyty w takiej ilości względem zawartego w roztworze wodorotlenku potasu, że w uzyskanej po zakończeniu doświadczenia mieszaninie (25 oC) stężenie jonów OH– było równe 2∙10–6 mol∙dm–3. W roztworze tym po zakończeniu doświadczenia uzyskano również mieszaninę dwóch soli.
Wskaż numery tych probówek, których zawartość przedstawiono w postaci fotografii wykonanej po wprowadzeniu tlenku bezbarwnego, a następnie wyjaśnij, dlaczego doświadczenie z wykorzystaniem tego tlenku przeprowadzono w warunkach praktycznie beztlenowych.
Numery probówek:
Wyjaśnienie:
© dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone