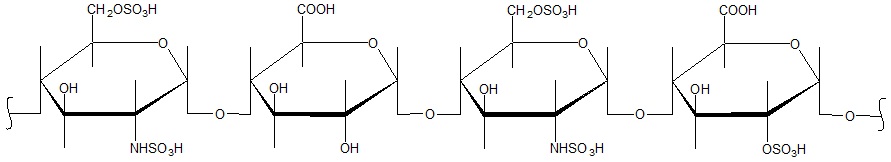
W celu ilościowego oraz jakościowego oznaczenia α-aminokwasów w próbce stosuje się trójetapowy proces analityczny:
Etap I: rozdział na kolumnie chromatograficznej, podczas którego wykorzystuje się różnice w czasie przepływu (t, minuty) aminokwasów przez kolumnę. Czas przebywania w kolumnie danego aminokwasu ma stałą i powtarzalną wartość.
Etap II: reakcja α-aminokwasu z ninhydryną, w wyniku której pojawia się tzw. purpura Ruhenmana – związek chemiczny o fioletowym zabarwieniu:
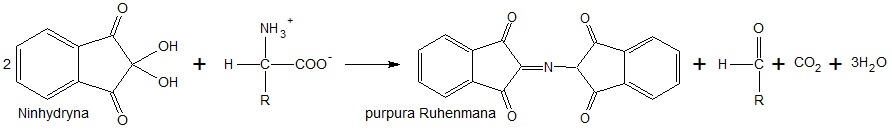
Etap III: spektrometryczny pomiar wartości absorbancji (A), która jest proporcjonalna do stężenia molowego purpury Ruhenmana. Im wyższe jest stężenie molowe α-aminokwasu, tym większa jest intensywność fioletowej barwy roztworu, a w konsekwencji – wartość absorbancji.
W tabeli zebrano dane na temat czasów (minuty) przebywania wybranych aminokwasów w kolumnie chromatograficznej.

Na podstawie: M. Gumińska, Zarys biochemii ogólnej dla studentów farmacji i analityki medycznej, Kraków 1998 oraz J. McMurry, Chemia organiczna, Warszawa 2012.
Przeprowadzono hydrolizę próbki zawierającej 0,01 mola pewnego oligopeptydu, który występuje w mózgu człowieka. Uzyskany roztwór stanowiący mieszaninę czterech rodzajów aminokwasów białkowych (X, Y, Z i Q) przepuszczono przez kolumnę chromatograficzną. Poniżej zebrano dane na temat produktów hydrolizy badanego oligopeptydu:
– Dodatek chlorku żelaza(III) do roztworu aminokwasu X, którego reszta stanowiła N-koniec peptydu spowodował pojawienie się fioletowego zabarwienia.
– Aminokwas Y, którego czas przebywania w kolumnie chromatograficznej wynosił około pół godziny nie wykazywał czynności optycznej i stanowił 40% sumarycznej liczby moli wszystkich aminokwasów uzyskanych w wyniku hydrolizy oligopeptydu.
– Tzw. C-końcowym aminokwasem Z w badanym peptydzie była reszta związku chemicznego, który w wyniku reakcji z ninhydryną daje aldehyd o szkielecie węglowym propanalu i zawierający grupę metylową połączoną z atomem siarki.
– Aminokwas Q, który jako ostatni opuścił kolumnę chromatograficzną, przy wartości pH = 7,3 występuje głównie w postaci anionu.
Ustal sekwencję aminokwasów w badanym oligopeptydzie, jeśli wiadomo, że w wyniku jego niepełnej hydrolizy uzyskuje się między innymi tripeptyd o sekwencji YYQ. W tym celu wykorzystaj trójliterowe oznaczenia odpowiednich aminokwasów.
Sekwencja aminokwasów badanego oligopeptydu:
© dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone