Określanie liczb wiązań sigma oraz pi w cząsteczce tlenku siarki(VI). Zadanie 5.2. Arkusz CKE chemia maj 2015 rozszerzony (1 punkt)
Budowa cząsteczki tlenku siarki(VI) jest skomplikowana. Poniżej przedstawiono jeden ze wzorów opisujących strukturę elektronową SO3.
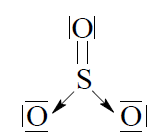
Napisz, ile wiązań σ i π występuje w cząsteczce SO3 o przedstawionej powyżej strukturze. Liczba wiązań σ: Liczba wiązań π:
Wyjaśnienie dlaczego KCl oraz NaCl nie mogą tworzyć kryształów mieszanych. Zadanie 6. Arkusz CKE chemia maj 2015 rozszerzony (1 punkt)
Substancje o tym samym typie wzoru chemicznego, tworzące ten sam typ sieci przestrzennej i o takich samych lub bardzo zbliżonych rozmiarach komórki elementarnej, nazywamy substancjami izomorficznymi. Mogą one tworzyć roztwory stałe, czyli kryształy mieszane. Tworzenie kryształów mieszanych polega na tym, że atomy lub jony wykazujące taki sam ładunek oraz zbliżone rozmiary mogą się wzajemnie zastępować w sieci przestrzennej. KCl i KBr mają identyczne sieci przestrzenne i wykazują zdolność tworzenia stałych roztworów. Natomiast w przypadku KCl i NaCl izomorfizm nie występuje mimo tego samego typu sieci.
W tabeli podano wielkości promienia jonowego czterech jonów.

Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2002.
Wyjaśnij, dlaczego chlorek potasu i chlorek sodu nie mogą tworzyć kryształów mieszanych.
Wybór poprawnych określeń dotyczących struktury wody ciekłej oraz lodu. Zadanie 7. Arkusz CKE chemia maj 2015 rozszerzony (1 punkt)
Poniżej przedstawiono model struktury wody w stanie stałym.
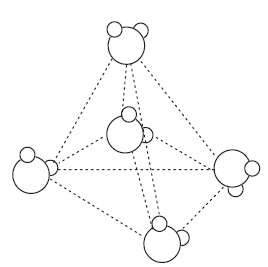
Uzupełnij zdania opisujące budowę i właściwości lodu. Podkreśl właściwe określenie spośród wymienionych w każdym nawiasie. W wodzie w stanie stałym, czyli w lodzie, każda cząsteczka wody związana jest wiązaniami (kowalencyjnymi / kowalencyjnymi spolaryzowanymi / wodorowymi / jonowymi) z czterema innymi cząsteczkami wody leżącymi w narożach czworościanu foremnego. Tworzy się w ten sposób luźna sieć cząsteczkowa o strukturze (diagonalnej / trygonalnej / tetraedrycznej), która pęka, gdy lód się topi, choć pozostają po niej skupiska zawierające 30 i więcej cząsteczek. W ciekłej wodzie cząsteczki zajmują przestrzeń mniejszą niż w sieci krystalicznej, a zatem woda o temperaturze zamarzania ma gęstość (większą / mniejszą) niż lód. Dlatego lód (tonie w / pływa po) wodzie. Na podstawie: K.-H. Lautenschläger, W. Schröter, A. Wanninger, Nowoczesne kompendium chemii, Warszawa 2007.
Określanie stechiometrii reagentów reakcji syntezy wody. Zadanie 8. Arkusz CKE chemia maj 2015 rozszerzony (2 punkty)
Do szczelnego zbiornika wprowadzono wodór oraz tlen i zainicjowano reakcję. Po jej zakończeniu naczynie zawierało wyłącznie 0,9 g wody.
Napisz, w jakim stosunku objętościowym i masowym zmieszano wodór z tlenem w zbiorniku, a także podaj, ile gramów wodoru i ile gramów tlenu znajdowało się w naczyniu przed zainicjowaniem reakcji. Stosunek objętościowy Vwodoru : Vtlenu = Stosunek masowy m wodoru : m tlenu = Masa wodoru przed zainicjowaniem reakcji m wodoru = Masa tlenu przed zainicjowaniem reakcji m tlenu =
Obliczanie wydajności procesu biegnącego z udziałem anhydrytu. Zadanie 9. Arkusz CKE chemia maj 2015 rozszerzony (2 punkty)
Tlenek siarki(IV) na skalę techniczną można otrzymać w wyniku redukcji siarczanu(VI) wapnia (anhydrytu) węglem w temperaturze 900 °C. Proces ten opisano poniższym równaniem.
![]()
Na podstawie: H. Koneczny, Podstawy technologii chemicznej, Warszawa 1973.
Oblicz, jaka była wydajność opisanego procesu, jeżeli z 1 kg czystego anhydrytu otrzymano 150 dm3 tlenku siarki(IV) w przeliczeniu na warunki normalne.
Wybór poprawnych określeń dotyczących termodynamiki reakcji anhydrytu z węglem. Zadanie 10. Arkusz CKE chemia maj 2015 rozszerzony (1 punkt)
Tlenek siarki(IV) na skalę techniczną można otrzymać w wyniku redukcji siarczanu(VI) wapnia (anhydrytu) węglem w temperaturze 900 °C. Proces ten opisano poniższym równaniem.
![]()
Na podstawie: H. Koneczny, Podstawy technologii chemicznej, Warszawa 1973.
Uzupełnij poniższe zdania. Podkreśl właściwe określenie spośród wymienionych w każdym nawiasie. Podniesienie temperatury, w której prowadzony jest proces otrzymywania tlenku siarki(IV), będzie przyczyną (zmniejszenia / zwiększenia) wydajności reakcji, gdyż jest to proces (egzoenergetyczny / endoenergetyczny). Stopień rozdrobnienia anhydrytu i węgla (ma wpływ / nie ma wpływu) na szybkość tej reakcji.
Projektowanie doświadczenia, którego celem jest uzyskanie stałego chlorku magnezu. Zadanie 11. Arkusz CKE chemia maj 2015 rozszerzony (1 punkt)
Dysponujesz niezbędnym sprzętem laboratoryjnym oraz następującymi odczynnikami:
– mieszaniną dwóch soli: stałego chlorku magnezu i stałego chlorku sodu,
– wodą destylowaną,
– kwasem solnym,
– wodnym roztworem wodorotlenku sodu.
Zaprojektuj doświadczenie, w wyniku którego otrzymasz czysty stały chlorek magnezu. Opisz kolejne etapy wykonania tego doświadczenia.
Porównanie wartości pH roztworów różnych związków chemicznych. Zadanie 12. Arkusz CKE chemia maj 2015 rozszerzony (1 punkt)
W temperaturze T przygotowano następujące roztwory:
1. wodny roztwór Ba(OH)2 o stężeniu 0,05 mol · dm–3
2. wodny roztwór KOH o stężeniu 0,1 mol · dm–3
3. wodny roztwór NH3 o stężeniu 0,1 mol · dm–3
4. wodny roztwór CH3COOH o stężeniu 0,1 mol · dm–3
Porównaj pH przygotowanych roztworów. Uzupełnij zdania wyrażeniami wybranymi spośród podanych poniżej. niższe niż równe wyższe niż pH roztworu 1. jest pH roztworu 2.
pH roztworu 2. jest pH roztworu 3.
pH roztworu 3. jest pH roztworu 4.
Wybór poprawnych określeń podczas porównania mocy kwasów tlenowych. Zadanie 13. Arkusz CKE chemia maj 2015 rozszerzony (1 punkt)
Uzupełnij poniższe zdania. Podkreśl właściwe określenie spośród wymienionych w każdym nawiasie. Po porównaniu stałych dysocjacji kwasu chlorowego(I) i kwasu chlorowego(III) można stwierdzić, że w cząsteczce kwasu chlorowego(I) wiązanie O–H jest (bardziej / mniej) spolaryzowane niż w cząsteczce kwasu chlorowego(III). Wodny roztwór kwasu chlorowego(I) ma więc (niższe / wyższe) pH od roztworu kwasu chlorowego(III) o tym samym stężeniu molowym. W wodnych roztworach soli sodowych tych kwasów uniwersalny papierek wskaźnikowy (pozostaje żółty / przyjmuje czerwone zabarwienie / przyjmuje niebieskie zabarwienie).
Wybór odczynników pozwalających na kolejne wytrącenie osadów odpowiednich soli. Zadanie 14.1. Arkusz CKE chemia maj 2015 rozszerzony (1 punkt)
W roztworze wodnym znajdują się kationy: Ba2+, Ag+ i Mg2+ oraz towarzyszące im aniony. Kationy te można wydzielić z roztworu za pomocą reakcji strąceniowych, stosując odpowiednie odczynniki w takiej kolejności, aby jeden odczynnik wytrącał z roztworu w postaci nierozpuszczalnej soli tylko jeden kation. Po przesączeniu osadu, używając innego odczynnika, można wytrącić z przesączu sól zawierającą kolejny kation.
Wpisz do tabeli wzory odczynników, których użycie pozwoli w trzech etapach (I, II i III) wytrącić kolejno z roztworu w postaci nierozpuszczalnych soli kationy w nim zawarte. Odczynniki wybierz spośród wymienionych poniżej. Na2CrO4 (aq) KNO3 (aq) NaCl (aq) NaOH (aq) K2SiO3 (aq)
Zapis wzorów sumarycznych soli strąconych w postaci osadów. Zadanie 14.2. Arkusz CKE chemia maj 2015 rozszerzony (1 punkt)
W roztworze wodnym znajdują się kationy: Ba2+, Ag+ i Mg2+ oraz towarzyszące im aniony. Kationy te można wydzielić z roztworu za pomocą reakcji strąceniowych, stosując odpowiednie odczynniki w takiej kolejności, aby jeden odczynnik wytrącał z roztworu w postaci nierozpuszczalnej soli tylko jeden kation. Po przesączeniu osadu, używając innego odczynnika, można wytrącić z przesączu sól zawierającą kolejny kation.
Napisz wzory nierozpuszczalnych soli powstałych w każdym etapie doświadczenia.
Określanie odczynów roztworów wodnych z uzasadnieniem równaniami procesów chemicznych. Zadanie 15. Arkusz CKE chemia maj 2015 rozszerzony (2 punkty)
Wykonano doświadczenie zilustrowane na poniższym schemacie.

Określ odczyn roztworu powstałego w probówce I i odczyn roztworu powstałego w probówce II oraz napisz w formie jonowej skróconej równania reakcji zachodzących podczas tego doświadczenia.
Wskazanie funkcji jaką pełnią podane jony w teorii Brønsteda. Zadanie 16. Arkusz CKE chemia maj 2015 rozszerzony (1 punkt)
Wykonano doświadczenie zilustrowane na poniższym schemacie.

Określ, jaką funkcję (kwasu czy zasady) według teorii Brønsteda−Lowry’ego pełnią w reakcjach zachodzących podczas opisanego doświadczenia jony NH4+ i jony C17H35COO−. Jony NH4+ pełnią funkcję: Jony C17H35COO− pełnią funkcję:
Wybór właściwego wykresu ilustrującego profil energetyczny dwuetapowego procesu. Zadanie 17. Arkusz CKE chemia maj 2015 rozszerzony (1 punkt)
Pewien proces, w którym związek A zostaje przekształcony w związek B, przebiega w dwóch etapach.
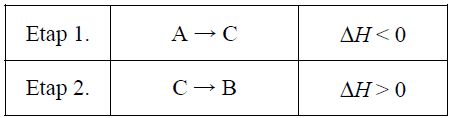
Przeanalizuj poniższe wykresy i ustal, który z nich odpowiada opisanej przemianie. Opisaną przemianę poprawnie zilustrowano na wykresie: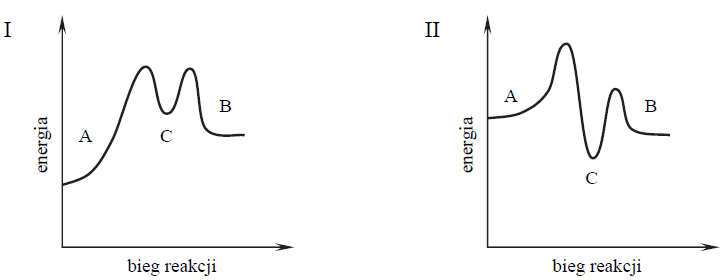
Obliczanie stężenia molowego nasyconego roztworu azotanu(V) potasu. Zadanie 18. Arkusz CKE chemia maj 2015 rozszerzony (2 punkty)
W temperaturze 20 °C rozpuszczalność azotanu(V) potasu jest równa 31,9 grama na 100 gramów wody.
Na podstawie: J. Sawicka i inni, Tablice chemiczne, Gdańsk 2004.
Oblicz stężenie molowe nasyconego wodnego roztworu azotanu(V) potasu w temperaturze 20 °C, jeżeli gęstość roztworu jest równa 1,16 g·cm−3.

