Wybór właściwej probówki oraz nazw wykorzystanych związków chemicznych
Zamieszczone fotografie I÷III przedstawiają w sposób losowy probówki wraz z zawartością w różnych etapach pewnego doświadczenia chemicznego. Do przeprowadzenia tego eksperymentu wykorzystano wodę amoniakalną oraz roztwór azotanu(V) srebra.

Rysunki poniżej ilustrują wzory kilku związków chemicznych.
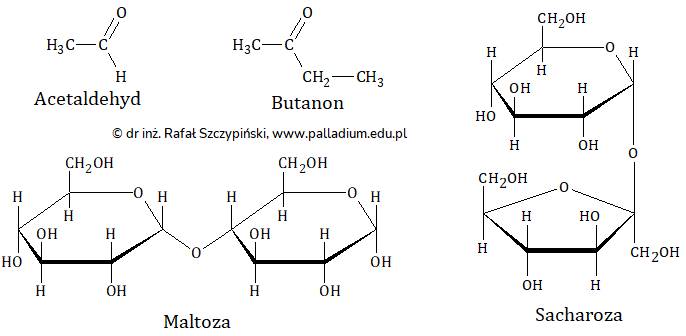
Podaj numer probówki przedstawiającej efekt końcowy przeprowadzonego doświadczenia chemicznego oraz nazwy tych spośród wymienionych związków chemicznych, które mogły być wykorzystane w tym eksperymencie. Numer probówki: Nazwy substancji: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zapis równania reakcji chemicznej, której przebieg skutkował utworzeniem zawartości określonego naczynia
Zamieszczone fotografie I÷III przedstawiają w sposób losowy probówki wraz z zawartością w różnych etapach pewnego doświadczenia chemicznego. Do przeprowadzenia tego eksperymentu wykorzystano wodę amoniakalną oraz roztwór azotanu(V) srebra.

Napisz w formie jonowej skróconej równanie reakcji chemicznej, której przebieg doprowadził do uzyskania zawartości probówki III. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wskazanie numeru probówki, nazwy naczynia oraz uzasadnienie wyboru
Fotografie I÷III przedstawiają probówki zawierające pewne mieszaniny poreakcyjne, a zdjęcie nr IV ilustruje naczynie służące do rozdziału niektórych rodzajów mieszanin.
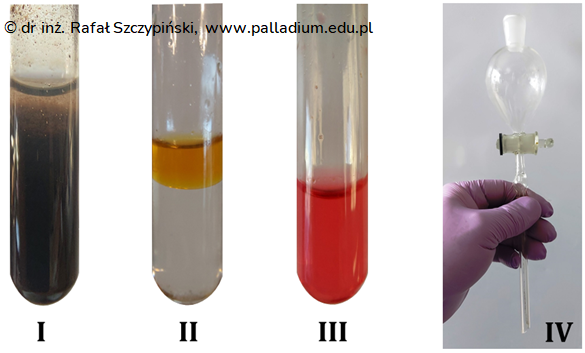
Podaj nazwę tego naczynia oraz wskaż numer probówki, której zawartość może zostać rozdzielona przy jego pomocy. Uzasadnij swój wybór. Nazwa naczynia: Numer wybranej probówki: Uzasadnienie wyboru: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Rozszyfrowanie symbolu pierwiastka chemicznego oraz określenie jego położenia w układzie okresowym. Zadanie 1.1. Arkusz CKE chemia maj 2016 rozszerzony (1 punkt)
Z konfiguracji elektronowej atomu (w stanie podstawowym) pierwiastka X wynika, że w tym atomie:
• elektrony rozmieszczone są na czterech powłokach elektronowych
• na podpowłoce 3d liczba elektronów sparowanych jest dwa razy mniejsza od liczby elektronów niesparowanych.
Uzupełnij poniższą tabelę – wpisz symbol pierwiastka X, dane dotyczące jego położenia w układzie okresowym oraz symbol bloku konfiguracyjnego (energetycznego), do którego należy pierwiastek X.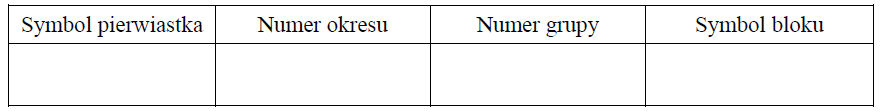
Uzupełnienie schematu klatkowego konfiguracji elektronowej rozszyfrowanego pierwiastka chemicznego. Zadanie 1.2. Arkusz CKE chemia maj 2016 rozszerzony (1 punkt)
Z konfiguracji elektronowej atomu (w stanie podstawowym) pierwiastka X wynika, że w tym atomie:
• elektrony rozmieszczone są na czterech powłokach elektronowych
• na podpowłoce 3d liczba elektronów sparowanych jest dwa razy mniejsza od liczby elektronów niesparowanych.
Uzupełnij poniższy zapis (stosując schematy klatkowe), tak aby przedstawiał on konfigurację elektronową atomu w stanie podstawowym pierwiastka X. W zapisie tym uwzględnij numery powłok i symbole podpowłok. Podkreśl ten fragment konfiguracji, który nie występuje w konfiguracji elektronowej jonu X2+ (stan podstawowy).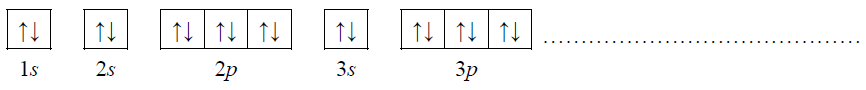
Ocena poprawności zdań dotyczących wapnia oraz potasu. Zadanie 2. Arkusz CKE chemia maj 2016 rozszerzony (1 punkt)
W poniższej tabeli zestawiono wybrane właściwości fizyczne potasu i wapnia.

Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2004.
Oceń, czy podane poniżej informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa. 1. Podczas reakcji wapnia i potasu z wodą te metale pływają po powierzchni wody, ponieważ gęstość każdego z nich jest mniejsza od gęstości wody. 2. Atomy wapnia i potasu, oddając elektrony walencyjne, przechodzą w dodatnio naładowane jony o konfiguracji elektronowej tego samego gazu szlachetnego. 3. Atomy wapnia są mniejsze od atomów potasu; dwudodatnie jony wapnia są mniejsze od jednododatnich jonów potasu.
Wybór poprawnych określeń dotyczących wapnia oraz potasu. Zadanie 3. Arkusz CKE chemia maj 2016 rozszerzony (1 punkt)
W poniższej tabeli zestawiono wybrane właściwości fizyczne potasu i wapnia.

Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2004.
Na podstawie informacji i układu okresowego pierwiastków uzupełnij poniższe zdania. Wybierz i zaznacz jedno właściwe określenie spośród podanych w każdym nawiasie. 1. Węzły sieci krystalicznych wapnia, jak i potasu obsadzone są (dodatnio / ujemnie) naładowanymi jonami zwanymi rdzeniami atomowymi. Pomiędzy rdzeniami atomowymi obecne są słabo związane elektrony walencyjne, które mogą wędrować swobodnie przez kryształ metalu. Dlatego zarówno wapń, jak i potas odznaczają się (dużą / małą) przewodnością elektryczną. 2. Temperatura topnienia wapnia jest (niższa / wyższa) niż temperatura topnienia potasu, co wynika między innymi (z silniejszego / ze słabszego) wiązania metalicznego, utworzonego z udziałem (mniejszej / większej) liczby elektronów walencyjnych.
Obliczanie składu mieszaniny poreakcyjnej uzyskanej w wyniku spalania amoniaku. Zadanie 4. Arkusz CKE chemia maj 2016 rozszerzony (2 punkty)
Do reaktora wprowadzono 1,0 mol amoniaku i 1,6 mola tlenu, a następnie przeprowadzono – w odpowiednich warunkach – reakcję zilustrowaną poniższym równaniem.
![]()
Wykonaj obliczenia i podaj skład mieszaniny poreakcyjnej wyrażony w molach. Załóż, że opisana przemiana przebiegła z wydajnością równą 100%.
Określenie, czy układ oddaje energię do otoczenia, czy ją przyjmuje. Zadanie 5. Arkusz CKE chemia maj 2016 rozszerzony (1 punkt)
W wyniku pewnej odwracalnej reakcji chemicznej z dwóch substratów powstaje jeden produkt. Przemiana przebiega w fazie gazowej, co oznacza, że oba substraty i produkt są gazami. Reakcję tę przeprowadzono w zamkniętym reaktorze przy użyciu stechiometrycznych ilości substratów w różnych temperaturach i pod różnym ciśnieniem. Na poniższym diagramie przedstawiono, jaki procent objętości mieszaniny poreakcyjnej w reaktorze stanowiła objętość produktu tej reakcji w zależności od warunków temperatury i ciśnienia, w jakich przebiegała.
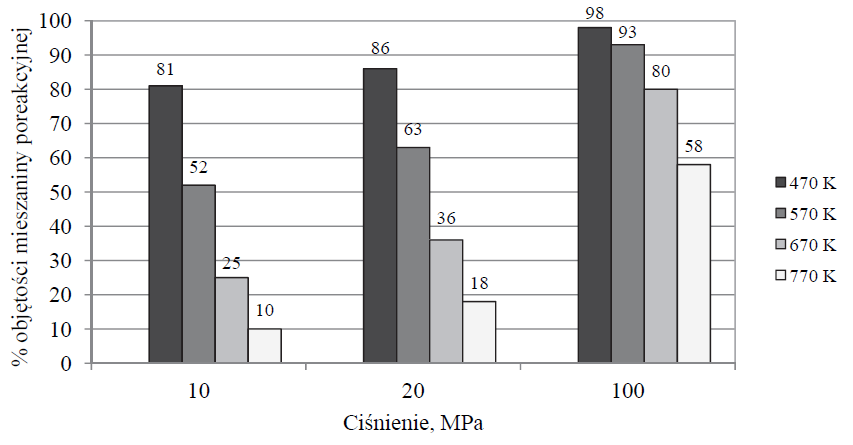
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
Na podstawie analizy diagramu określ, czy w czasie opisanej reakcji układ oddaje energię do otoczenia, czy przyjmuje ją od otoczenia. Odpowiedź uzasadnij.
Określenie, czy liczba moli substratów jest większa, równa, bądź mniejsza od liczby moli produktów. Zadanie 6. Arkusz CKE chemia maj 2016 rozszerzony (1 punkt)
W wyniku pewnej odwracalnej reakcji chemicznej z dwóch substratów powstaje jeden produkt. Przemiana przebiega w fazie gazowej, co oznacza, że oba substraty i produkt są gazami. Reakcję tę przeprowadzono w zamkniętym reaktorze przy użyciu stechiometrycznych ilości substratów w różnych temperaturach i pod różnym ciśnieniem. Na poniższym diagramie przedstawiono, jaki procent objętości mieszaniny poreakcyjnej w reaktorze stanowiła objętość produktu tej reakcji w zależności od warunków temperatury i ciśnienia, w jakich przebiegała.

Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
Na podstawie analizy diagramu określ, czy w równaniu stechiometrycznym opisanej reakcji łączna liczba moli substratów jest mniejsza, czy – większa od liczby moli produktu, czy też – równa liczbie moli produktu. Odpowiedź uzasadnij.
Wybór właściwego równania reakcji chemicznej na podstawie diagramu opisującego zawartość reagenta w zależności od ciśnienia i temperatury. Zadanie 7. Arkusz CKE chemia maj 2016 rozszerzony (1 punkt)
W wyniku pewnej odwracalnej reakcji chemicznej z dwóch substratów powstaje jeden produkt. Przemiana przebiega w fazie gazowej, co oznacza, że oba substraty i produkt są gazami. Reakcję tę przeprowadzono w zamkniętym reaktorze przy użyciu stechiometrycznych ilości substratów w różnych temperaturach i pod różnym ciśnieniem. Na poniższym diagramie przedstawiono, jaki procent objętości mieszaniny poreakcyjnej w reaktorze stanowiła objętość produktu tej reakcji w zależności od warunków temperatury i ciśnienia, w jakich przebiegała.

Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
Spośród reakcji, których równania przedstawiono poniżej, wybierz tę, do której mógłby odnosić się przedstawiony diagram. Zaznacz wybraną odpowiedź. 1. H2 (g) + Cl2 (g) → 2HCl (g) ΔH < 0 2. H2 (g) + I2 (g) → 2HI (g) ΔH > 0 3. N2 (g) + 3H2 (g) → 2NH3 (g) ΔH < 0 4. 2Cl2 (g) + O2 (g) → 2Cl2O (g) ΔH > 0
Obliczanie stopnia dysocjacji amoniaku. Zadanie 8. Arkusz CKE chemia maj 2016 rozszerzony (2 punkty)
Amoniak bardzo dobrze rozpuszcza się wodzie, a w powstałym roztworze zachodzi reakcja opisana równaniem:
NH3 + H2O ⇄ NH4+ + OH–
Oblicz, jaki procent wszystkich wprowadzonych do wody cząsteczek amoniaku ulega tej reakcji w wodnym roztworze amoniaku o stężeniu 0,1 mol·dm–3 w temperaturze 298 K. Przyjmij, że (w opisanych warunkach) reakcji ulega mniej niż 5% wprowadzonych do wody cząsteczek amoniaku.
Wybór odpowiedniego odczynnika do reakcji z tlenkiem baru. Zadanie 9.1. Arkusz CKE chemia maj 2016 rozszerzony (1 punkt)
Aby potwierdzić zasadowy charakter tlenku baru, przeprowadzano reakcję tego tlenku z pewnym odczynnikiem w obecności wskaźnika pH, którym była czerwień bromofenolowa. Wskaźnik ten w roztworach o pH < 5,2 ma barwę żółtą, a w roztworach o pH > 6,8 przyjmuje barwę czerwoną. W roztworach o 5,2 < pH < 6,8 barwi się na kolor pośredni między żółtym a czerwonym (różne odcienie barwy pomarańczowej).
Do probówki wprowadzono wybrany odczynnik z dodatkiem czerwieni bromofenolowej, a następnie dodano nadmiar stałego tlenku baru, dokładnie mieszając jej zawartość. Zaobserwowano, że dodany tlenek baru roztworzył się całkowicie, a powstały w probówce klarowny roztwór zmienił zabarwienie.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
Uzupełnij poniższy schemat wykonania doświadczenia. Wpisz wzór odczynnika wybranego spośród następujących: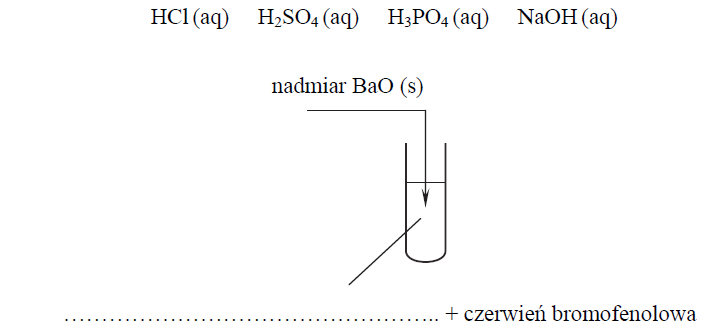
Opis zabarwienia zawartości probówki przed i po wprowadzeniu tlenku baru. Zadanie 9.2. Arkusz CKE chemia maj 2016 rozszerzony (1 punkt)
Aby potwierdzić zasadowy charakter tlenku baru, przeprowadzano reakcję tego tlenku z pewnym odczynnikiem w obecności wskaźnika pH, którym była czerwień bromofenolowa. Wskaźnik ten w roztworach o pH < 5,2 ma barwę żółtą, a w roztworach o pH > 6,8 przyjmuje barwę czerwoną. W roztworach o 5,2 < pH < 6,8 barwi się na kolor pośredni między żółtym a czerwonym (różne odcienie barwy pomarańczowej).
Do probówki wprowadzono wybrany odczynnik z dodatkiem czerwieni bromofenolowej, a następnie dodano nadmiar stałego tlenku baru, dokładnie mieszając jej zawartość. Zaobserwowano, że dodany tlenek baru roztworzył się całkowicie, a powstały w probówce klarowny roztwór zmienił zabarwienie.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
Wybierz opisany odczynnik spośród:
![]()
Napisz, jakie było zabarwienie zawartości probówki przed wprowadzeniem tlenku baru i po jego wprowadzeniu do roztworu znajdującego się w probówce.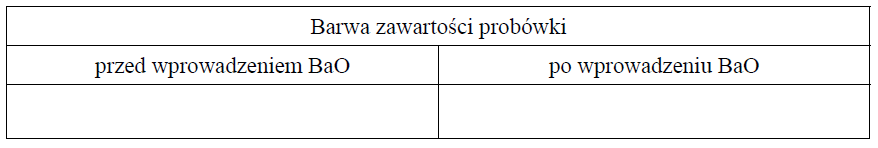
Zapis równań reakcji połówkowych z wykorzystaniem bilansu jonowo-elektronowego bez określania stopni utlenienia. Zadanie 10.1. Arkusz CKE chemia maj 2016 rozszerzony (1 punkt)
Jednym z tlenowych kwasów siarki jest kwas trioksotiosiarkowy (nazwa zwyczajowa: kwas tiosiarkowy) o wzorze H2S2O3. Anion S2O32– (tiosiarczanowy) ma strukturę analogiczną do struktury jonu siarczanowego(VI), z tą różnicą, że zamiast jednego atomu tlenu zawiera atom siarki. Centralnemu atomowi siarki w jonie S2O32– odpowiada stopień utlenienia (VI), a skrajnemu – stopień utlenienia (–II). Kwas tiosiarkowy jest substancją nietrwałą, trwałe są natomiast sole tego kwasu – tiosiarczany. Spośród tych soli największe znaczenie ma tiosiarczan sodu – zwykle występujący jako pentahydrat o wzorze Na2S2O3 · 5H2O. Znajduje on zastosowanie w przemyśle włókienniczym jako substancja służąca do usuwania resztek chloru używanego do bielenia tkanin. Podczas zachodzącej reakcji chlor utlenia jony S2O32– do jonów siarczanowych(VI). W przemianie tej udział bierze również woda.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2004.
Napisz w formie jonowej z uwzględnieniem liczby oddawanych lub pobieranych elektronów (zapis jonowo-elektronowy) równanie reakcji redukcji i równanie reakcji utleniania zachodzących podczas procesu usuwania resztek chloru użytego do bielenia tkanin za pomocą jonów tiosiarczanowych. Uwzględnij, że w przemianie bierze udział woda. Równanie reakcji redukcji: Równanie reakcji utleniania:

