Zapis jonowego równania reakcji chemicznej. Zadanie 15.1. Arkusz CKE chemia czerwiec 2024 rozszerzony (1 punkt)
Wprowadzenie CO2 do roztworu pozostającego w równowadze z osadem węglanów powoduje ich przemianę w lepiej rozpuszczalne wodorowęglany. Stężenie CO2 w roztworze zwiększa się wraz ze wzrostem ciśnienia tego gazu w mieszaninie gazów (np. w powietrzu) nad roztworem. W tabeli przedstawiono stężenie jonów Ca2+ w roztworze pozostającym w równowadze z osadem węglanu wapnia w zależności od ciśnienia CO2 w mieszaninie gazów nad roztworem (w temperaturze 𝑇).

Na podstawie: A. M. Trzeciak, Wstęp do chemii nieorganicznej środowiska, Wrocław 1995.
Węglan ołowiu(II) jest białym ciałem stałym. Przeprowadzono doświadczenie, w którym do dwóch probówek dodano niewielką ilość węglanu ołowiu(II) oraz wodę i otrzymano zawiesinę.
Przez zawiesinę znajdującą się w pierwszej probówce przepuszczono CO2 i zaobserwowano zanik osadu.
Napisz w formie jonowej równanie reakcji zachodzącej w tej probówce.
Zapis równań połówkowych reakcji utleniania oraz redukcji. Zadanie 16. Arkusz CKE chemia czerwiec 2024 rozszerzony formuła 2015 (2 punkty)
Po wprowadzeniu tlenku chloru(IV) do wodnego roztworu wodorotlenku sodu zachodzi reakcja opisana schematem:
ClO2 + OH– ⟶ ClO2– + ClO3– + H2O
Napisz w formie jonowej z uwzględnieniem liczby oddawanych lub pobieranych elektronów (zapis jonowo-elektronowy) równania reakcji redukcji i utleniania zachodzących podczas opisanego procesu. Uwzględnij środowisko reakcji. Równanie reakcji redukcji: Równanie reakcji utleniania:
Zapis w formie jonowej skróconej równania reakcji chemicznej. Zadanie 17.1. Arkusz CKE chemia czerwiec 2024 rozszerzony formuła 2015 (1 punkt)
Metale X i E tworzą jony proste – odpowiednio – X2+ i E2+. Blaszki o znanych masach, wykonane z metalu X i z metalu E, zanurzono w roztworach soli trzech różnych metali, zgodnie ze schematem:
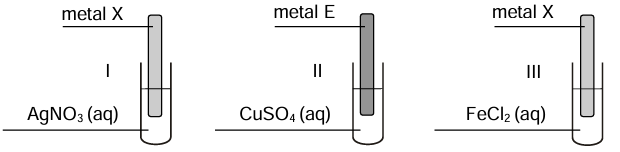
Objawy świadczące o zajściu reakcji chemicznych zaobserwowano w probówkach I i II. Po zakończeniu doświadczenia blaszki osuszono i zważono. Stwierdzono, że masa blaszki wykonanej z metalu X wzrosła, a masa blaszki wykonanej z metalu E zmalała.
Zastosuj symbol X i napisz w formie jonowej skróconej równanie reakcji zachodzącej w probówce I.
Zapis równania reakcji chemicznej oraz wyjaśnienie przyczyny zmiany wyglądu zawartości probówki. Zadanie 15.2. Arkusz CKE chemia czerwiec 2024 rozszerzony (1 punkt)
Wprowadzenie CO2 do roztworu pozostającego w równowadze z osadem węglanów powoduje ich przemianę w lepiej rozpuszczalne wodorowęglany. Stężenie CO2 w roztworze zwiększa się wraz ze wzrostem ciśnienia tego gazu w mieszaninie gazów (np. w powietrzu) nad roztworem. W tabeli przedstawiono stężenie jonów Ca2+ w roztworze pozostającym w równowadze z osadem węglanu wapnia w zależności od ciśnienia CO2 w mieszaninie gazów nad roztworem (w temperaturze 𝑇).

Na podstawie: A. M. Trzeciak, Wstęp do chemii nieorganicznej środowiska, Wrocław 1995.
Węglan ołowiu(II) jest białym ciałem stałym. Przeprowadzono doświadczenie, w którym do dwóch probówek dodano niewielką ilość węglanu ołowiu(II) oraz wodę i otrzymano zawiesinę.
Do drugiej probówki dodano niewielką ilość świeżo przygotowanego wodnego roztworu KI i nie zaobserwowano żadnych zmian. Następnie przez zawiesinę znajdującą się w tej probówce przepuszczono CO2. Wygląd zawartości probówki po zakończeniu doświadczenia pokazano na zdjęciu.

Napisz w formie jonowej skróconej równanie reakcji, której rezultat pokazano na zdjęciu. Wyjaśnij, dlaczego zmiany wyglądu zawartości probówki zaobserwowano dopiero po przepuszczeniu tlenku węgla(IV) przez zawiesinę PbCO3. W odpowiedzi uwzględnij zmiany stężenia drobin będące konsekwencją wpływu CO2 na proces rozpuszczania węglanu. Równanie reakcji: Wyjaśnienie:
Obliczanie wydajności reakcji tworzenia jodku ołowiu(II). Zadanie 16. Arkusz CKE chemia czerwiec 2024 rozszerzony (2 punkty)
W temperaturze 𝑇 do zlewki zawierającej 50,0 g wodnego roztworu jodku potasu o stężeniu równym 2,00 % dodano 100 cm3 wodnego roztworu azotanu(V) ołowiu(II) o stężeniu równym 0,0300 mol ∙ dm−3. Przebiegła reakcja wytrącania PbI2. Otrzymany osad po odsączeniu i wysuszeniu ważył 1,24 g.
Oblicz wydajność reakcji otrzymywania jodku ołowiu(II) w opisanym doświadczeniu w temperaturze T.
Ocena poprawności zdań dotyczących doświadczenia z udziałem metali oraz roztworów soli. Zadanie 17.2. Arkusz CKE chemia czerwiec 2024 rozszerzony formuła 2015 (1 punkt)
Metale X i E tworzą jony proste – odpowiednio – X2+ i E2+. Blaszki o znanych masach, wykonane z metalu X i z metalu E, zanurzono w roztworach soli trzech różnych metali, zgodnie ze schematem:

Objawy świadczące o zajściu reakcji chemicznych zaobserwowano w probówkach I i II. Po zakończeniu doświadczenia blaszki osuszono i zważono. Stwierdzono, że masa blaszki wykonanej z metalu X wzrosła, a masa blaszki wykonanej z metalu E zmalała.
Oceń prawdziwość poniższych zdań. Zaznacz P, jeśli zdanie jest prawdziwe, albo F – jeśli jest fałszywe. 1. Metal X jest silniejszym reduktorem niż srebro. 2. Jony żelaza(II) są silniejszym utleniaczem niż jony metalu X.
Zapis nazw metali użytych podczas doświadczenia. Zadanie 17.3. Arkusz CKE chemia czerwiec 2024 rozszerzony formuła 2015 (1 punkt)
Metale X i E tworzą jony proste – odpowiednio – X2+ i E2+. Blaszki o znanych masach, wykonane z metalu X i z metalu E, zanurzono w roztworach soli trzech różnych metali, zgodnie ze schematem:

Objawy świadczące o zajściu reakcji chemicznych zaobserwowano w probówkach I i II. Po zakończeniu doświadczenia blaszki osuszono i zważono. Stwierdzono, że masa blaszki wykonanej z metalu X wzrosła, a masa blaszki wykonanej z metalu E zmalała.
Poniżej podano nazwy czterech metali.
magnez miedź kadm srebro
Wybierz i napisz nazwę metalu X i nazwę metalu E, które mogły być użyte w doświadczeniu. Metal X: Metal E:
Obliczanie stężenia molowego wodorotlenku magnezu w jego nasyconym roztworze. Zadanie 17.1. Arkusz CKE chemia czerwiec 2024 rozszerzony (1 punkt)
Wykonano dwuetapowe doświadczenie. Podczas obu etapów utrzymywano temperaturę równą 25 °C.
Etap I: Do zlewki zawierającej wodę destylowaną dodano stały wodorotlenek magnezu. Po pewnym czasie w zlewce ustalił się stan równowagi między osadem a roztworem, czyli powstał nasycony roztwór tej substancji.
Etap II: Osad oddzielono od roztworu pozostającego z nim w równowadze. Otrzymany przesącz umieszczono w dwóch probówkach. Do jednej probówki wprowadzono stały wodorotlenek potasu, a do drugiej – rozcieńczony kwas solny, co zilustrowano na rysunku.
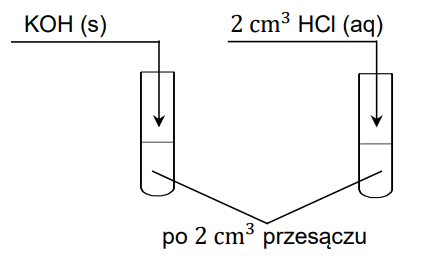
Oblicz stężenie molowe jonów Mg2+ w roztworze pozostającym w równowadze z osadem w etapie I doświadczenia (w temperaturze 25 °C).
Rozstrzygnięcie z uzasadnieniem, czy nastąpiła zmiana stężenia jonów magnezu. Zadanie 17.2. Arkusz CKE chemia czerwiec 2024 rozszerzony (2 punkty)
Wykonano dwuetapowe doświadczenie. Podczas obu etapów utrzymywano temperaturę równą 25 °C.
Etap I: Do zlewki zawierającej wodę destylowaną dodano stały wodorotlenek magnezu. Po pewnym czasie w zlewce ustalił się stan równowagi między osadem a roztworem, czyli powstał nasycony roztwór tej substancji.
Etap II: Osad oddzielono od roztworu pozostającego z nim w równowadze. Otrzymany przesącz umieszczono w dwóch probówkach. Do jednej probówki wprowadzono stały wodorotlenek potasu, a do drugiej – rozcieńczony kwas solny, co zilustrowano na rysunku.

Rozstrzygnij, czy w II etapie doświadczenia dodanie stałego wodorotlenku potasu do jednej próbki przesączu i kwasu solnego do drugiej próbki poskutkowało zmianą stężenia jonów Mg2+ w roztworze (w temperaturze 25 °C). Wybierz i zaznacz jedną odpowiedź spośród podanych w każdym nawiasie. Odpowiedzi uzasadnij. Dodanie stałego wodorotlenku potasu do próbki przesączu (poskutkowało zmniejszeniem / poskutkowało zwiększeniem / nie wpłynęło na wartość) stężenia jonów Mg2+ w roztworze. Uzasadnienie: Dodanie kwasu solnego do próbki przesączu (poskutkowało zmniejszeniem / poskutkowało zwiększeniem / nie wpłynęło na wartość) stężenia jonów Mg2+ w roztworze. Uzasadnienie:
Wybór właściwych wyrazów dotyczących reakcji uwodornienia. Zadanie 18. Arkusz CKE chemia czerwiec 2024 rozszerzony formuła 2015 (1 punkt)
W tabeli podano wartości standardowej entalpii uwodornienia: cykloheksenu, cykloheksa-1,3-dienu i benzenu:
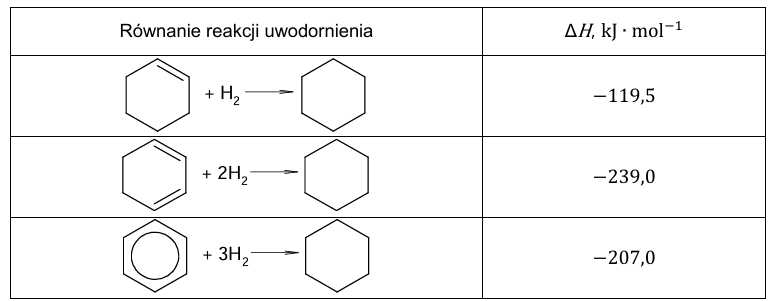
Na podstawie danych zamieszczonych w tabeli uzupełnij poniższe zdania. Wybierz i zaznacz jedną odpowiedź spośród podanych w każdym nawiasie. Gdyby wiązania 𝜋 w cząsteczce benzenu nie były zdelokalizowane, entalpia uwodornienia tego związku miałaby znacznie (niższą / wyższą) wartość niż −207,0 kJ∙mol−1. Delokalizacja wiązań 𝜋 skutkuje (zwiększeniem / zmniejszeniem) trwałości cząsteczki benzenu.
Zapis równania reakcji otrzymywania alkoholu ze styrenu. Zadanie 19. Arkusz CKE chemia czerwiec 2024 rozszerzony formuła 2015 (1 punkt)
Propan-1-ol oraz wyższe alkohole pierwszorzędowe można otrzymać w procesie hydroformylowania alkenów terminalnych. Reakcja przebiega w warunkach podwyższonego ciśnienia i temperatury, w obecności katalizatorów (Co lub Ru) według schematu:
![]()
Na podstawie: R. Franke, D. Selent, A. Börner, Applied Hydroformylation, „Chem. Rev.” 2012, nr 112 (11), s. 5675–5732,
oraz I. Ojima, C.Y. Tsai, M. Tzamarioudaki, D. Bonafoux, The Hydroformylation Reaction, „Org. React.” 2000, nr 56, s. 1.
Napisz równanie reakcji otrzymywania alkoholu ze styrenu (fenyloetenu) opisaną metodą. Zastosuj wzory półstrukturalne (grupowe) lub uproszczone związków organicznych.
Zapis sumarycznego równania reakcji biegnącej w ogniwie oraz obliczenie wartości SEM w stanie standardowym. Zadanie 18. Arkusz CKE chemia czerwiec 2024 rozszerzony (1 punkt)
Zbudowano dwa półogniwa I i II, w których zachodzą reakcje opisane równaniami:
Półogniwo I: Co3+ + ē ⇄ Co2+
Półogniwo II: MnO4– + 8H+ + 5ē ⇄ Mn2+ + 4H2O
Napisz w formie jonowej skróconej sumaryczne równanie reakcji zachodzącej w ogniwie zbudowanym z półogniw I i II w warunkach standardowych. Oblicz SEM tego ogniwa. Równanie reakcji: SEM:
Wybór właściwych wyrazów dotyczących entalpii uwodornienia oraz trwałości. Zadanie 19. Arkusz CKE chemia czerwiec 2024 rozszerzony (1 punkt)
W tabeli podano wartości standardowej entalpii uwodornienia: cykloheksenu, cykloheksa-1,3-dienu i benzenu:
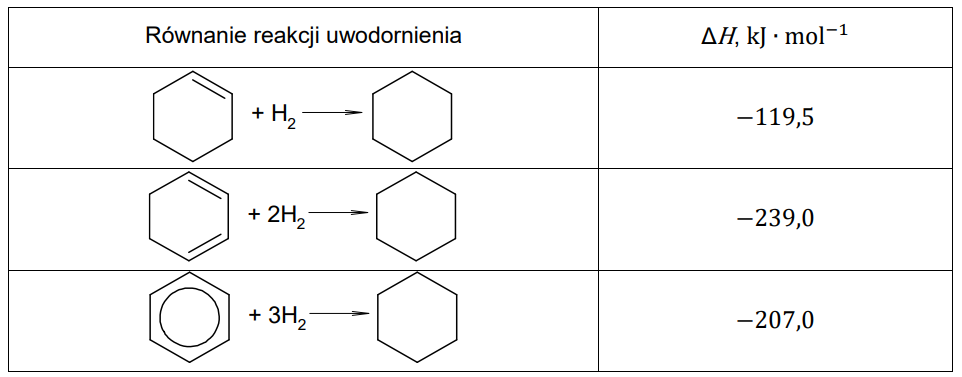
Na podstawie danych zamieszczonych w tabeli uzupełnij poniższe zdania. Wybierz i zaznacz jedną odpowiedź spośród podanych w każdym nawiasie. Gdyby wiązania 𝜋 w cząsteczce benzenu nie były zdelokalizowane, entalpia uwodornienia tego związku miałaby znacznie (niższą / wyższą) wartość niż −207,0 kJ ∙ mol−1. Delokalizacja wiązań 𝜋 skutkuje (zwiększeniem / zmniejszeniem) trwałości cząsteczki benzenu.
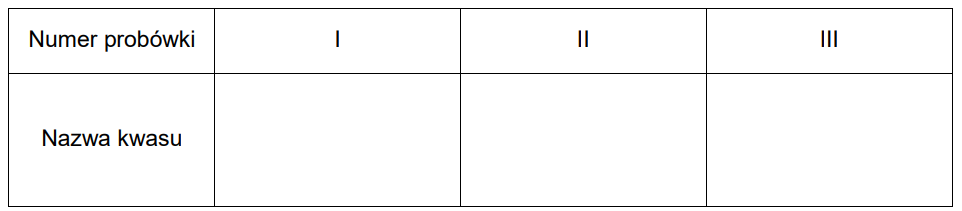
Wpisanie nazw kwasów użytych podczas eksperymentu. Zadanie 20.1. Arkusz CKE chemia czerwiec 2024 rozszerzony formuła 2015 (1 punkt)
W zlewkach I, II i III umieszczono – w przypadkowej kolejności – wodne roztwory kwasów:
mlekowego (2-hydroksypropanowego), migdałowego (2-fenylo-2-hydroksyetanowego) i galusowego (3,4,5-trihydroksybenzenokarboksylowego). Wzory kwasów przedstawiono
poniżej.
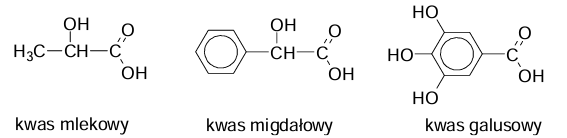
W celu zidentyfikowania substancji przeprowadzono dwie próby.
W pierwszej próbie do trzech probówek z wodnym roztworem chlorku żelaza(III) wprowadzono po kilka kropel roztworów badanych substancji ze zlewek I, II i III. Do każdej probówki z chlorkiem żelaza(III) dodano roztwór jednego kwasu.
W drugiej próbie w trzech probówkach umieszczono po jednej z identyfikowanych substancji, oznaczając je zgodnie z oznaczeniem zlewki z której zostały pobrane. Następnie do probówek wprowadzono stężony kwas azotowy(V) z dodatkiem stężonego kwasu siarkowego(VI) i probówki ogrzano.
Wyniki przeprowadzonych prób przedstawiono w poniższej tabeli.
Uzupełnij tabelę. Wpisz nazwy kwasów, które były obecne w zlewkach I, II i III.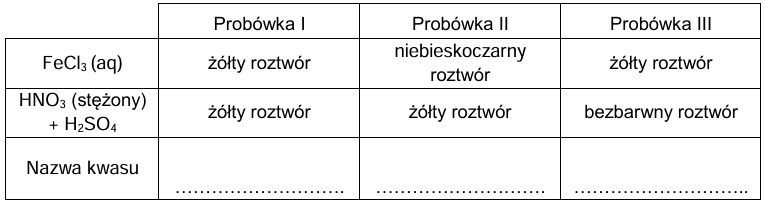
Przypisanie nazwy kwasu do odpowiedniej probówki. Zadanie 20.1. Arkusz CKE chemia czerwiec 2024 rozszerzony (1 punkt)
W zlewkach I, II i III umieszczono – w przypadkowej kolejności – wodne roztwory kwasów: mlekowego (2-hydroksypropanowego), migdałowego (2-fenylo-2-hydroksyetanowego) i galusowego (3,4,5-trihydroksybenzenokarboksylowego). Wzory kwasów przedstawiono poniżej.
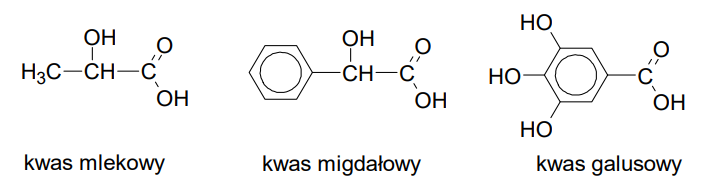
W celu zidentyfikowania substancji przeprowadzono dwie próby.
W pierwszej próbie do trzech probówek z wodnym roztworem chlorku żelaza(III) wprowadzono po kilka kropel roztworów badanych substancji ze zlewek I, II i III. Do każdej probówki z chlorkiem żelaza(III) dodano roztwór jednego kwasu. W drugiej próbie w trzech probówkach umieszczono po jednej z identyfikowanych substancji, oznaczając je zgodnie z oznaczeniem zlewki z której zostały pobrane. Następnie do probówek wprowadzono stężony kwas azotowy(V) z dodatkiem stężonego kwasu siarkowego(VI) i probówki ogrzano. Wygląd zawartości probówek po przeprowadzeniu opisanych prób przedstawiono na zdjęciach w tabeli.

Uzupełnij tabelę. Wpisz nazwy kwasów, które były obecne w zlewkach I, II i III.