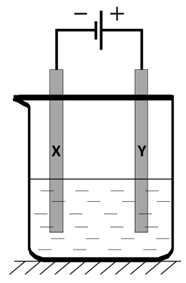
Zapis równań połówkowych procesu elektrolizy stopionego węglanu potasu (elektroliza)
Gdy elektrolizie z użyciem elektrod platynowych poddaje się stopione nieamonowe sole kwasów tlenowych, w procesie anodowym zwykle wydziela się tlen oraz odpowiedni tlenek kwasowy. Opisanej elektrolizie uległo 6,9 g stopionego węglanu potasu i wydzieliła się mieszanina gazów. W celu oczyszczenia znajdującego się w niej tlenu, mieszanina została przepuszczona przez płuczkę zawierającą 200 cm3 wodnego roztworu wodorotlenku sodu.
Napisz równania reakcji jakie przebiegły – w procesie katodowym oraz anodowym podczas opisanego doświadczenia. Proces katodowy: Proces anodowy: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie procentu ładunku elektrycznego faktycznie zużytego podczas elektrolizy stopionego węglanu potasu (elektroliza)
Gdy elektrolizie z użyciem elektrod platynowych poddaje się stopione nieamonowe sole kwasów tlenowych, w procesie anodowym zwykle wydziela się tlen oraz odpowiedni tlenek kwasowy. Opisanej elektrolizie uległo 6,9 g stopionego węglanu potasu i wydzieliła się mieszanina gazów. W celu oczyszczenia znajdującego się w niej tlenu, mieszanina została przepuszczona przez płuczkę zawierającą 200 cm3 wodnego roztworu wodorotlenku sodu. Podczas przepływu prądu elektrycznego, dochodzi do strat energii. Jedną z przyczyn tego zjawiska jest zamiana energii elektrycznej na energię cieplną.
Oblicz, jaki procent ładunku elektrycznego został faktycznie zużyty na przeprowadzenie opisanego procesu elektrolizy, jeśli zebrany tlen zajął objętość 580 cm3 (295 K, 1003 hPa). © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie czasu trwania elektrolizy podczas którego wzrosło stężenie procentowe roztworu soli (elektroliza)
Przygotowano 250 g wodnego roztworu siarczanu(VI) sodu o stężeniu 7,1%.
Oblicz, ile godzin należałoby prowadzić elektrolizę prądem o natężeniu 5,66 A z wykorzystaniem elektrod platynowych, aby stężenie roztworu wzrosło do 7,5%? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wybór poprawnych określeń dotyczących elektrolizy roztworów siarczanu(VI) miedzi(II) przy użyciu różnych elektrod (elektroliza)
W dwóch elektrolizerach przez 18 minut prowadzono elektrolizę wodnego roztworu siarczanu(VI) miedzi(II) prądem o natężeniu 795 mA, przy czym w pierwszym z urządzeń zastosowano elektrody miedziane, a w drugim platynowe. Stężenia oraz objętości poddanych elektrolizie roztworów były jednakowe i wynosiły odpowiednio 0,1 mol·dm–3 oraz 400 cm3.
Podkreśl wyrażenia w nawiasach tak, aby powstały zdania prawdziwe. W pierwszym z elektrolizerów masa anody (wzrosła/zmalała/nie uległa zmianie), natomiast w drugim (wzrosła/zmalała/nie uległa zmianie). W tym samym czasie, w (każdym/jednym) z elektrolizerów, w przestrzeni katodowej przebiegł proces (utleniania miedzi/redukcji jonów Cu2+), dlatego masa katody w tym elektrolizerze (zmalała/nie uległa zmianie/wzrosła). © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie objętości mieszaniny gazów wydzielonych podczas elektrolizy przy określonej wydajności prądowej (elektroliza)
W dwóch elektrolizerach przez 18 minut prowadzono elektrolizę wodnego roztworu siarczanu(VI) miedzi(II) prądem o natężeniu 795 mA, przy czym w pierwszym z urządzeń zastosowano elektrody miedziane, a w drugim platynowe. Stężenia oraz objętości poddanych elektrolizie roztworów były jednakowe i wynosiły odpowiednio 0,1 mol·dm–3 oraz 400 cm3.
Produktem ubocznym w pierwszym elektrolizerze była mieszanina gazów.
Oblicz jej objętość w temperaturze 25 oC pod ciśnieniem 1020 hPa, jeśli w warunkach prowadzonego procesu wydajność prądowa wydzielania każdego z gazów wyniosła 5%. Wynik podaj w centymetrach sześciennych, z dokładnością do cyfry jedności. Przyjmij, że uniwersalna stała gazowa ma wartość 83,1 hPa∙dm³∙mol–1∙K–1, natomiast stała Faradaya 96500 C. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie liczby jonów miedzi(II) jakie pozostały po zakończeniu elektrolizy (elektroliza)
W dwóch elektrolizerach przez 18 minut prowadzono elektrolizę wodnego roztworu siarczanu(VI) miedzi(II) prądem o natężeniu 795 mA, przy czym w pierwszym z urządzeń zastosowano elektrody miedziane, a w drugim platynowe. Stężenia oraz objętości poddanych elektrolizie roztworów były jednakowe i wynosiły odpowiednio 0,1 mol·dm–3 oraz 400 cm3.
Policz liczbę moli jonów Cu2+ jakie pozostały w roztworze po zakończeniu elektrolizy w drugim z urządzeń. Przyjmij, że w warunkach prowadzonego procesu wydajność prądowa wydzielania miedzi wyniosła 90%. Wynik podaj z dokładnością do dwóch cyfr znaczących. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wyodrębnianie tlenku chromu(III) z mieszaniny poreakcyjnej uzyskanej w wyniku wstrzymania rozkładu dwuchromianu(VI) amonu
Na skalę laboratoryjną tlenek chromu(III) otrzymuje się podczas termicznego rozkładu dwuchromianu(VI) amonu:
(NH4)2Cr2O7 ⟶ Cr2O3 + N2 + 4H2O
Przez 10 sekund w tyglu porcelanowym prażono 12,6 g dwuchromianu(VI) amonu. Po tym czasie reakcję wstrzymano przez gwałtowne schłodzenie zawartości naczynia, a następnie ostrożnie odparowano powstałą wodę. Masa stałej pozostałości wynosiła 9,27 g.
Opisz w kilku zdaniach, w jaki sposób można odzyskać z mieszaniny poreakcyjnej tlenek chromu(III), powstały w warunkach opisanych w informacji wprowadzającej? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wyodrębnianie dwuchromianu(VI) amonu z mieszaniny poreakcyjnej uzyskanej w wyniku częściowego jego rozkładu
Na skalę laboratoryjną tlenek chromu(III) otrzymuje się podczas termicznego rozkładu dwuchromianu(VI) amonu:
(NH4)2Cr2O7 ⟶ Cr2O3 + N2 + 4H2O
Przez 10 sekund w tyglu porcelanowym prażono 12,6 g dwuchromianu(VI) amonu. Po tym czasie reakcję wstrzymano przez gwałtowne schłodzenie zawartości naczynia, a następnie ostrożnie odparowano powstałą wodę. Masa stałej pozostałości wynosiła 9,27 g.
Opisz w kilku zdaniach, w jaki sposób można odzyskać pozostały dwuchromian(VI) amonu z powstałej mieszaniny poreakcyjnej, jeśli wiadomo, że związek ten praktycznie nie rozpuszcza się w acetonie? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zapis równań reakcji redoks elektrolizy roztworu AgNO3 z wykorzystaniem elektrod srebrnych (elektroliza)
W dwóch elektrolizerach umieszczono wodny roztwór AgNO3 o stężeniu 0,2 mol∙dm–3 i przeprowadzono jego elektrolizę. W pierwszym naczyniu zastosowano elektrody srebrne, a w drugim – platynowe. W jednym z elektrolizerów proces prowadzono tak długo, aż w układzie (poza wodą) znajdował się również wyłącznie nowy, praktycznie całkowicie zdysocjowany na jony związek chemiczny.
Napisz równania połówkowe głównych reakcji redoks, jakie przebiegły podczas opisanego doświadczenia w przestrzeni katodowej oraz anodowej tego elektrolizera, w którym zastosowano elektrody srebrne. Przestrzeń katodowa: Przestrzeń anodowa: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wskazanie nazwy związku chemicznego, jaki powstał podczas elektrolizy roztworu AgNO3 z uzasadnieniem (elektroliza)
W dwóch elektrolizerach umieszczono wodny roztwór AgNO3 o stężeniu 0,2 mol∙dm–3 i przeprowadzono jego elektrolizę. W pierwszym naczyniu zastosowano elektrody srebrne, a w drugim – platynowe. W jednym z elektrolizerów proces prowadzono tak długo, aż w układzie (poza wodą) znajdował się również wyłącznie nowy, praktycznie całkowicie zdysocjowany na jony związek chemiczny.
Podaj nazwę związku chemicznego, którego roztwór uzyskano w wyniku przeprowadzonego procesu elektrolizy z udziałem elektrod platynowych. Uzasadnij swoją odpowiedź. Nazwa związku chemicznego: Uzasadnienie: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zapis równań reakcji chemicznych na podstawie przeprowadzonego eksperymentu z udziałem azotku magnezu
Na pewną ilość azotku magnezu (Mg3N2) podziałano w nadmiarze wodą z dodatkiem kilku kropli alkoholowego roztworu fenoloftaleiny. W opisanych warunkach prowadzonego doświadczenia oprócz wodorotlenku magnezu powstał również bezbarwny gaz o charakterystycznej, drażniącej woni, który zbierano w baloniku. Po zakończeniu reakcji balonik zamknięto, wypuszczono i zaobserwowano jego unoszenie się do góry. Pozostałą w kolbie mieszaninę wyprażono do stałej masy i uzyskano 10 g białej substancji, w której jony magnezowe stanowiły 60% (procenty wagowe).
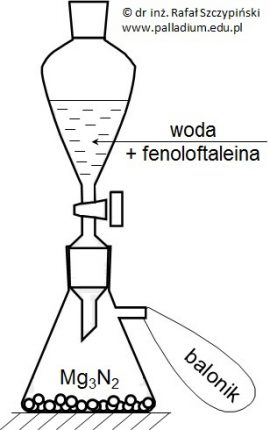
Napisz równania obu reakcji chemicznych i określ, jaką barwę przyjmie roztwór (faza wodna) uzyskany w wyniku przebiegu pierwszej z nich? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Ustalanie zawartości dwutlenku krzemu w próbce piasku
Wiadomo, że w skład próbki piasku o masie 20 g wchodzi dwutlenek krzemu oraz kalcyt – odmiana węglanu wapnia. Zawartość kalcytu bardzo często stanowi nawet 20% masy próbki.
Opisz, jak w sposób doświadczalny można ustalić udział procentowy (procent wagowy) dwutlenku krzemu w podanej masie próbki piasku, jeśli dostępne są dowolne odczynniki nieorganiczne oraz szkło i aparatura laboratoryjna? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone