Obliczanie stężenia procentowego soli bezwodnej na podstawie rozpuszczalności jej hydratu. Zadanie 19. Arkusz CKE chemia maj 2018 rozszerzony (2 punkty)
W temperaturze 20 oC rozpuszczalność uwodnionego wodorosiarczanu(VI) sodu o wzorze NaHSO4 · H2O jest równa 67 gramów w 100 gramach wody.
Na podstawie: T. Mizerski, Tablice chemiczne, Warszawa 2004.
Oblicz, jaki procent masy roztworu nasyconego o temperaturze 20 oC stanowi masa soli bezwodnej NaHSO4.
Zapis równania reakcji otrzymywania wodorotlenku niklu(II). Zadanie 20. Arkusz CKE chemia maj 2018 rozszerzony (1 punkt)
Wodorotlenek niklu(II) strąca się jako zielonkawy osad z wodnego roztworu soli niklu(II) pod działaniem wodnego roztworu wodorotlenku sodu. Wodorotlenek niklu(II) nie rozpuszcza się w nadmiarze zasady, ale reaguje z kwasami. Pod wpływem utleniaczy ten wodorotlenek przechodzi w czarnobrunatny wodorotlenek niklu(III).
Na podstawie: J. Minczewski, Z. Marczenko, Chemia analityczna. Podstawy teoretyczne i analiza jakościowa, Warszawa 2001.
Do probówki z wodnym roztworem chlorku niklu(II) dodano nadmiar wodnego roztworu wodorotlenku sodu.
Napisz w formie jonowej skróconej równanie reakcji otrzymywania wodorotlenku niklu(II) w sposób opisany powyżej. Określ charakter chemiczny (kwasowy, zasadowy, obojętny, amfoteryczny) wodorotlenku niklu(II). Równanie reakcji: Charakter chemiczny wodorotlenku niklu(II):
Zapis równań połówkowych procesu utleniania oraz redukcji ze wskazaniem stosunku molowego utleniacza do reduktora. Zadanie 21. Arkusz CKE chemia maj 2018 rozszerzony (2 punkty)
Wodorotlenek niklu(II) strąca się jako zielonkawy osad z wodnego roztworu soli niklu(II) pod działaniem wodnego roztworu wodorotlenku sodu. Wodorotlenek niklu(II) nie rozpuszcza się w nadmiarze zasady, ale reaguje z kwasami. Pod wpływem utleniaczy ten wodorotlenek przechodzi w czarnobrunatny wodorotlenek niklu(III).
Na podstawie: J. Minczewski, Z. Marczenko, Chemia analityczna. Podstawy teoretyczne i analiza jakościowa, Warszawa 2001.
Utlenianie wodorotlenku niklu(II) do wodorotlenku niklu(III) za pomocą chloranu(I) sodu przebiega w środowisku wodnym zgodnie ze schematem:
![]()
Napisz w formie jonowej z uwzględnieniem liczby oddawanych lub pobieranych elektronów (zapis jonowo-elektronowy) równania procesów redukcji i utleniania zachodzących podczas opisanej reakcji. Określ stosunek molowy reduktora do utleniacza w tej reakcji. Równanie procesu redukcji: Równanie procesu utleniania: Stosunek molowy nreduktora : nutleniacza =
Opis zawartości naczynia po zakończeniu każdego etapu doświadczenia chemicznego. Zadanie 22. Arkusz CKE chemia maj 2018 rozszerzony (1 punkt)
Wodorotlenek niklu(II) strąca się jako zielonkawy osad z wodnego roztworu soli niklu(II) pod działaniem wodnego roztworu wodorotlenku sodu. Wodorotlenek niklu(II) nie rozpuszcza się w nadmiarze zasady, ale reaguje z kwasami. Pod wpływem utleniaczy ten wodorotlenek przechodzi w czarnobrunatny wodorotlenek niklu(III).
Na podstawie: J. Minczewski, Z. Marczenko, Chemia analityczna. Podstawy teoretyczne i analiza jakościowa, Warszawa 2001.
Do probówki zawierającej zielony roztwór chlorku niklu(II) dodano wodny roztwór wodorotlenku sodu, a następnie – bezbarwny wodny roztwór chloranu(I) sodu – zgodnie ze schematem:
![]()
Opisz wygląd zawartości probówki na początku doświadczenia oraz po reakcji I i po reakcji II. Uwzględnij rodzaj mieszaniny (roztwór, zawiesina) oraz jej barwę.
Określanie wzoru sumarycznego węglowodoru na podstawie danych ilościowych spalania składników mieszaniny. Zadanie 23. Arkusz CKE chemia maj 2018 rozszerzony (2 punkty)
Do całkowitego spalenia 2,80 dm3 (odmierzonych w warunkach normalnych) mieszaniny zawierającej 60% objętościowych pewnego gazowego alkanu i 40% objętościowych metanu potrzeba 13,16 dm3 tlenu w przeliczeniu na warunki normalne. Reakcje całkowitego spalania metanu oraz dowolnego alkanu przebiegają zgodnie z równaniami:
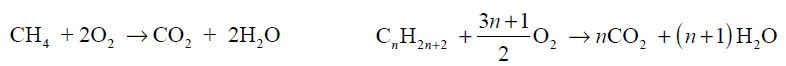
Wykonaj niezbędne obliczenia i podaj wzór sumaryczny alkanu stanowiącego 60% objętości opisanej mieszaniny.
Wybór poprawnych wyrazów dotyczących reakcji addycji przebiegającej według różnych mechanizmów. Zadanie 24. Arkusz CKE chemia maj 2018 rozszerzony (1 punkt)
Na przebieg reakcji propenu z bromowodorem ma wpływ obecność nadtlenków w mieszaninie reakcyjnej, co zilustrowano na poniższym schemacie.
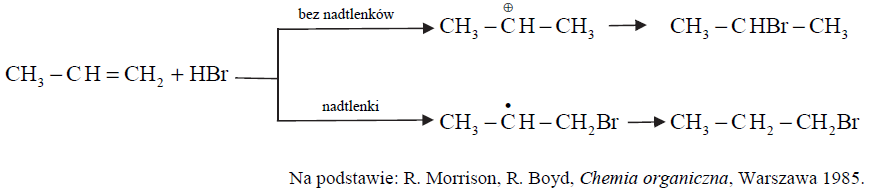
Uzupełnij poniższe zdania – wybierz i podkreśl jedno określenie spośród podanych w nawiasie. Gdy w środowisku reakcji nie ma nadtlenków, bromowodór przyłącza się do propenu (niezgodnie / zgodnie) z regułą Markownikowa. Ta addycja przebiega poprzez tworzenie drobin z ładunkiem dodatnim zlokalizowanym na atomie węgla. Jest to addycja (rodnikowa / nukleofilowa / elektrofilowa) do podwójnego wiązania węgiel – węgiel. Gdy w środowisku reakcji są obecne nadtlenki, addycja jest (niezgodna / zgodna) z regułą Markownikowa. W tej reakcji przejściowo tworzy się (karbokation pierwszorzędowy / karbokation drugorzędowy / rodnik pierwszorzędowy / rodnik drugorzędowy).
Zapis równania reakcji uwodornienia węglowodoru, którego wzór trzeba odszyfrować. Zadanie 25. Arkusz CKE chemia maj 2018 rozszerzony (1 punkt)
W poniższej tabeli zestawiono informacje na temat cząsteczek trzech węglowodorów o prostych (nierozgałęzionych) łańcuchach węglowych.
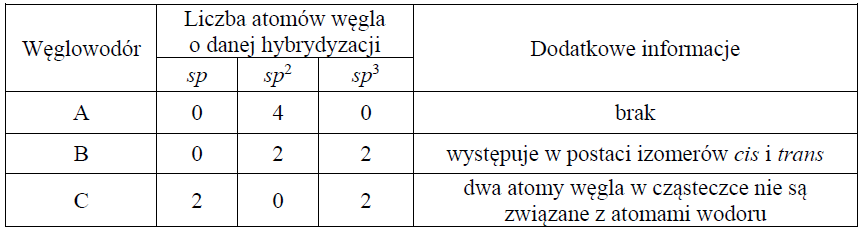
Przeprowadzono reakcję węglowodoru A z wodorem, w której stosunek molowy węglowodoru do wodoru był równy nwęglowodoru A : nH2 = 1: 2.
Napisz równanie reakcji węglowodoru A z wodorem. Zastosuj wzory półstrukturalne (grupowe) związków organicznych.
Rysowanie wzoru izomeru cis węglowodoru, którego wzór trzeba odszyfrować. Zadanie 26. Arkusz CKE chemia maj 2018 rozszerzony (1 punkt)
W poniższej tabeli zestawiono informacje na temat cząsteczek trzech węglowodorów o prostych (nierozgałęzionych) łańcuchach węglowych.

Narysuj wzór półstrukturalny (grupowy) izomeru cis węglowodoru B.
Zapis wzoru półstrukturalnego trwałego produktu reakcji addycji wody do węglowodoru. Zadanie 27. Arkusz CKE chemia maj 2018 rozszerzony (1 punkt)
W poniższej tabeli zestawiono informacje na temat cząsteczek trzech węglowodorów o prostych (nierozgałęzionych) łańcuchach węglowych.

Przeprowadzono reakcję węglowodoru C z wodą w stosunku molowym nwęglowodoru C : nwody = 1:1
Napisz wzór półstrukturalny (grupowy) trwałego (dominującego) produktu reakcji, której substratami są węglowodór C i woda.
Zapis równania reakcji chloroetanu z litem oraz równania reakcji metylolitu z wodą. Zadanie 28.1. Arkusz CKE chemia maj 2018 rozszerzony (2 punkty)
Chlorowcopochodne alkanów reagują z metalicznym litem, w wyniku czego tworzą związki litoorganiczne (których wzór w uproszczeniu można zapisać jako RLi). Reakcja przebiega zgodnie ze schematem:
RX +2Li → RLi + LiX
Związki litoorganiczne gwałtownie reagują z wodą z wydzieleniem wolnego węglowodoru. Roztwór po takiej reakcji ma odczyn zasadowy. W reakcjach związków litoorganicznych z jodkiem miedzi(I) powstaje związek miedziolitoorganiczny R2CuLi zgodnie z poniższym schematem:
2RLi + CuI → R2CuLi + LiI
Związek R2CuLi jest zwany odczynnikiem Gilmana. Ten odczynnik może reagować z inną chlorowcopochodną, w wyniku czego tworzy odpowiedni węglowodór (R–R’), co zilustrowano schematem:
R2CuLi + R’X → R–R’ + LiX + RCu
Na podstawie: J. McMurry, Chemia organiczna, Warszawa 2000.
Napisz: • w formie cząsteczkowej równanie reakcji chloroetanu z litem. Związki organiczne przedstaw za pomocą wzorów półstrukturalnych (grupowych). • w formie cząsteczkowej równanie reakcji metylolitu (CH3Li) z wodą.
Zapis równania reakcji tworzenia 2-metylopropanu z wykorzystaniem odczynnika Gilmana. Zadanie 28.2. Arkusz CKE chemia maj 2018 rozszerzony (1 punkt)
Chlorowcopochodne alkanów reagują z metalicznym litem, w wyniku czego tworzą związki litoorganiczne (których wzór w uproszczeniu można zapisać jako RLi). Reakcja przebiega zgodnie ze schematem:
RX +2Li → RLi + LiX
Związki litoorganiczne gwałtownie reagują z wodą z wydzieleniem wolnego węglowodoru. Roztwór po takiej reakcji ma odczyn zasadowy. W reakcjach związków litoorganicznych z jodkiem miedzi(I) powstaje związek miedziolitoorganiczny R2CuLi zgodnie z poniższym schematem:
2RLi + CuI → R2CuLi + LiI
Związek R2CuLi jest zwany odczynnikiem Gilmana. Ten odczynnik może reagować z inną chlorowcopochodną, w wyniku czego tworzy odpowiedni węglowodór (R–R’), co zilustrowano schematem:
R2CuLi + R’X → R–R’ + LiX + RCu
Na podstawie: J. McMurry, Chemia organiczna, Warszawa 2000.
Przeprowadzono reakcję, podczas której na drugorzędową chloropochodną alkanu podziałano odczynnikiem Gilmana. Wśród produktów reakcji obecny był 2-metylopropan.
Napisz w formie cząsteczkowej równanie opisanej reakcji. Chloropochodną alkanu oraz 2-metylopropan przedstaw za pomocą wzorów półstrukturalnych (grupowych).
Określenie rodzaju wiązania chemicznego między węglem oraz litem w butylolicie. Zadanie 29. Arkusz CKE chemia maj 2018 rozszerzony (1 punkt)
Chlorowcopochodne alkanów reagują z metalicznym litem, w wyniku czego tworzą związki litoorganiczne (których wzór w uproszczeniu można zapisać jako RLi). Reakcja przebiega zgodnie ze schematem:
RX +2Li → RLi + LiX
Związki litoorganiczne gwałtownie reagują z wodą z wydzieleniem wolnego węglowodoru. Roztwór po takiej reakcji ma odczyn zasadowy. W reakcjach związków litoorganicznych z jodkiem miedzi(I) powstaje związek miedziolitoorganiczny R2CuLi zgodnie z poniższym schematem:
2RLi + CuI → R2CuLi + LiI
Związek R2CuLi jest zwany odczynnikiem Gilmana. Ten odczynnik może reagować z inną chlorowcopochodną, w wyniku czego tworzy odpowiedni węglowodór (R–R’), co zilustrowano schematem:
R2CuLi + R’X → R–R’ + LiX + RCu
Na podstawie: J. McMurry, Chemia organiczna, Warszawa 2000.
Przeprowadzono reakcję, podczas której na drugorzędową chloropochodną alkanu podziałano odczynnikiem Gilmana. Wśród produktów reakcji obecny był 2-metylopropan.
Temperatura topnienia butylolitu (C4H9Li) jest znacznie niższa od 0 oC.
Na podstawie różnicy elektroujemności między litem a węglem oraz informacji wprowadzającej dotyczącej temperatury topnienia butylolitu określ rodzaj wiązania węgiel – lit.
Rysowanie wzorów grupowych - węglowodoru oraz produktu jego nitrowania. Zadanie 30.1. Arkusz CKE chemia maj 2018 rozszerzony (1 punkt)
Poniżej przedstawiono ciąg przemian chemicznych, w wyniku których ze związku I otrzymano związek IV. Związek I to homolog benzenu. Jego cząsteczka zbudowana jest z siedmiu atomów węgla.
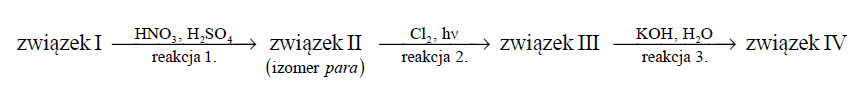
Związki II–IV są głównymi produktami organicznymi przemian opisanych schematem.
Napisz wzory półstrukturalne (grupowe) lub uproszczone związków I i II.
Określenie typów oraz mechanizmów reakcji chemicznych. Zadanie 30.2. Arkusz CKE chemia maj 2018 rozszerzony (1 punkt)
Poniżej przedstawiono ciąg przemian chemicznych, w wyniku których ze związku I otrzymano związek IV. Związek I to homolog benzenu. Jego cząsteczka zbudowana jest z siedmiu atomów węgla.
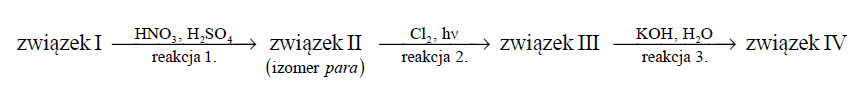
Związki II–IV są głównymi produktami organicznymi przemian opisanych schematem.
Określ typ reakcji (addycja, eliminacja, substytucja) oraz mechanizm (elektrofilowy, nukleofilowy, rodnikowy) reakcji 2. i 3.
Zapis równania reakcji chemicznej chloropochodnej z wodnym roztworem KOH. Zadanie 30.3. Arkusz CKE chemia maj 2018 rozszerzony (1 punkt)
Poniżej przedstawiono ciąg przemian chemicznych, w wyniku których ze związku I otrzymano związek IV. Związek I to homolog benzenu. Jego cząsteczka zbudowana jest z siedmiu atomów węgla.
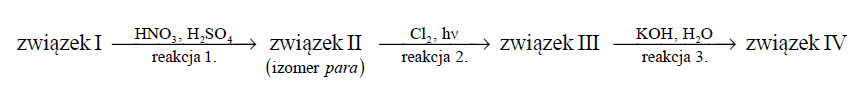
Związki II–IV są głównymi produktami organicznymi przemian opisanych schematem.
Napisz w formie cząsteczkowej równanie reakcji 3. Związki organiczne przedstaw za pomocą wzorów półstrukturalnych (grupowych) lub uproszczonych.

