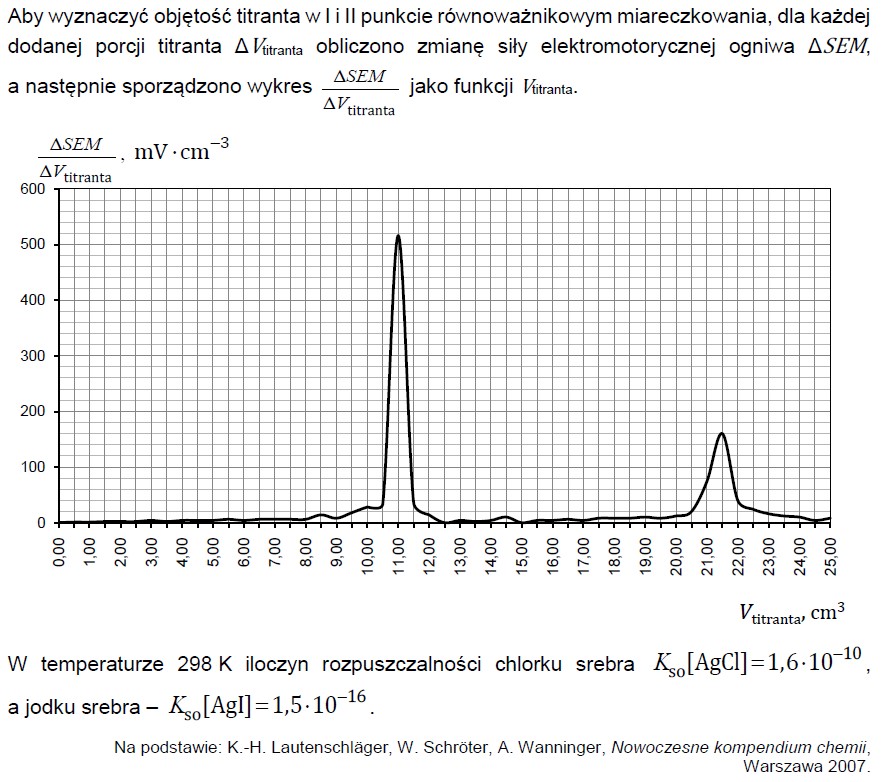
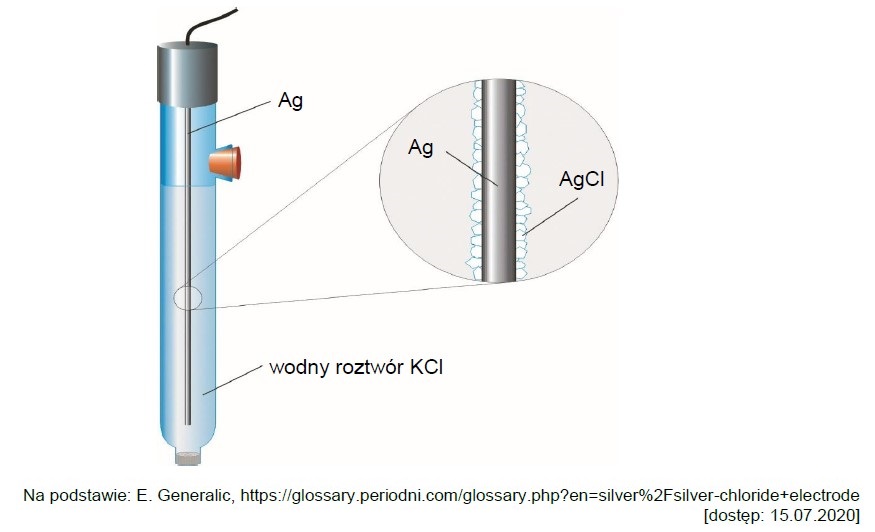
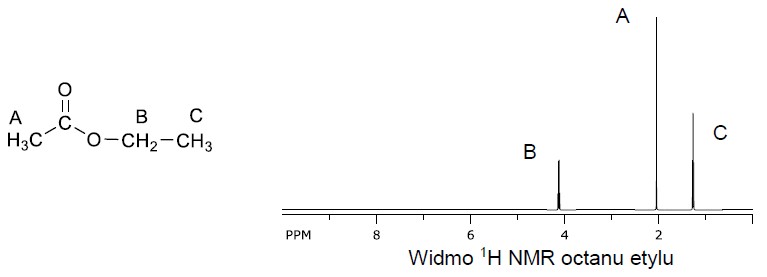
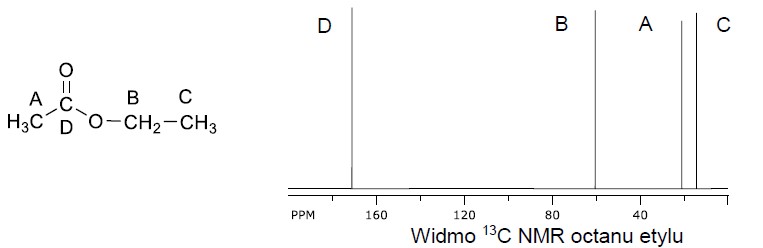
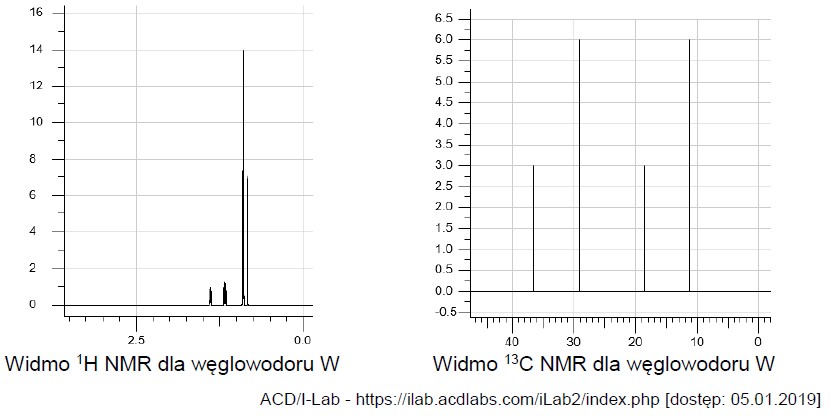
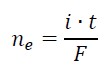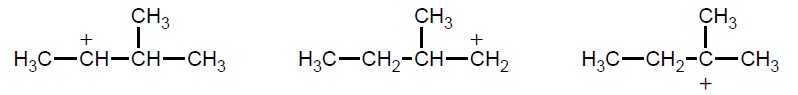Zapis równań reakcji połówkowych w procesie elektrolizy zakwaszonego roztworu bromku potasu. Zadanie 39.1. Informator CKE chemia 2023 rozszerzony (1 punkt)
Heksacyjanożelazian(II) potasu to sól zawierająca kompleksowy jon o wzorze [Fe(CN)6]4–. Zawartość tego związku w badanej próbce można określić na podstawie jego reakcji ze znaną ilością bromu.
Przeprowadzono doświadczenie, którego celem było określenie liczby moli heksacyjanożelazianu(II) potasu w roztworze. Aby przygotować roztwór bromu o znanym stężeniu, zastosowano metodę elektrolitycznego wytwarzania bromu w układzie dwóch elektrod platynowych. W tym celu w zlewce umieszczono roztwór bromku potasu i kwasu siarkowego(VI) o znanym stężeniu. Następnie do tego roztworu dodano próbkę K4Fe(CN)6 o nieznanym stężeniu. W tak sporządzonym roztworze zanurzono dwie platynowe elektrody oznaczone symbolami E1 oraz E2 i przeprowadzono elektrolizę prądem o natężeniu 0,005 A. W jej wyniku wydzielił się brom, który przereagował z K4Fe(CN)6. Wydajność obu reakcji wynosiła 100%.
Napisz równania reakcji przebiegających na anodzie i na katodzie podczas opisanego procesu wytwarzania bromu. Anoda: Katoda:
Zapis równań reakcji połówkowych dla reakcji heksacyjanożelazianu(II) z bromem. Zadanie 39.2. Informator CKE chemia 2023 rozszerzony (1 punkt)
Heksacyjanożelazian(II) potasu to sól zawierająca kompleksowy jon o wzorze [Fe(CN)6]4–. Zawartość tego związku w badanej próbce można określić na podstawie jego reakcji ze znaną ilością bromu.
Przeprowadzono doświadczenie, którego celem było określenie liczby moli heksacyjanożelazianu(II) potasu w roztworze. Aby przygotować roztwór bromu o znanym stężeniu, zastosowano metodę elektrolitycznego wytwarzania bromu w układzie dwóch elektrod platynowych. W tym celu w zlewce umieszczono roztwór bromku potasu i kwasu siarkowego(VI) o znanym stężeniu. Następnie do tego roztworu dodano próbkę K4Fe(CN)6 o nieznanym stężeniu. W tak sporządzonym roztworze zanurzono dwie platynowe elektrody oznaczone symbolami E1 oraz E2 i przeprowadzono elektrolizę prądem o natężeniu 0,005 A. W jej wyniku wydzielił się brom, który przereagował z K4Fe(CN)6. Wydajność obu reakcji wynosiła 100%.
Jon heksacyjanożelazianu(II) reaguje z bromem zgodnie ze schematem:
Br2 + Fe(CN)64– → Br– + Fe(CN)63–
Napisz w formie jonowej skróconej z uwzględnieniem liczby oddawanych lub pobieranych elektronów (zapis jonowo-elektronowy) równania procesów redukcji i utleniania zachodzących podczas opisanej przemiany. Równanie reakcji redukcji: Równanie reakcji utlenienia:
Przyporządkowanie temperatury wrzenia do węglowodoru z uzasadnieniem. Zadanie 40. Informator CKE chemia 2023 rozszerzony (3 punkty)
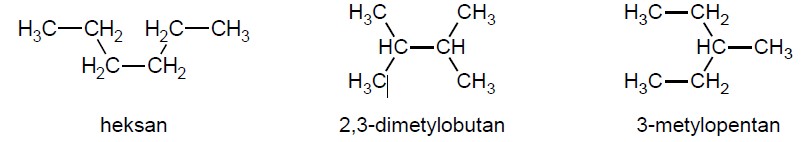
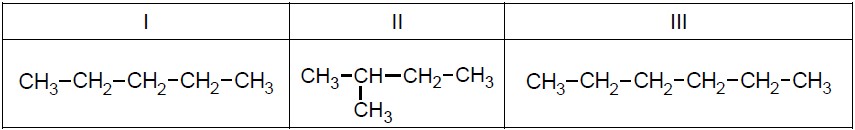
Wzory trzech związków organicznych oznaczono numerami I–III i zestawiono w poniższej tabeli. Te związki różnią się wartościami temperatury wrzenia.
Poniżej przedstawiono – w przypadkowej kolejności – wartości temperatury wrzenia wymienionych związków (pod ciśnieniem 1013 hPa):
27,8 °C 36,1 °C 68,7 °C
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2003.
Przyporządkuj każdemu związkowi charakteryzującą go temperaturę wrzenia. Uzupełnij tabelę. Podaj nazwę systematyczną związku o najwyższej temperaturze wrzenia i nazwę systematyczną związku o najniższej temperaturze wrzenia. W obu przypadkach uzasadnij swoje przyporządkowanie. Nazwa systematyczna związku o najwyższej temperaturze wrzenia: Uzasadnienie: Nazwa systematyczna związku o najniższej temperaturze wrzenia: Uzasadnienie:
Zapis równania reakcji mononitrowania oraz nazwy jej organicznego produktu. Zadanie 43.1. Informator CKE chemia 2023 rozszerzony (1 punkt)
Dwa węglowodory aromatyczne – A i B – mają wzór sumaryczny C8H10. Izomer A w wyniku reakcji nitrowania tworzy wyłącznie jedną mononitropochodną. Izomer B poddany reakcji monochlorowania w obecności światła, a następnie – reakcji z wodnym roztworem KOH, tworzy alkohol drugorzędowy.
Napisz równanie reakcji mononitrowania związku A – zastosuj wzory półstrukturalne (grupowe) lub uproszczone związków organicznych. Podaj nazwę systematyczną produktu mononitrowania związku A. Równanie reakcji: Nazwa systematyczna produktu mononitrowania związku A:
Uzupełnienie schematu ciągu reakcji z udziałem związków organicznych. Zadanie 43.2. Informator CKE chemia 2023 rozszerzony (1 punkt)
Dwa węglowodory aromatyczne – A i B – mają wzór sumaryczny C8H10. Izomer A w wyniku reakcji nitrowania tworzy wyłącznie jedną mononitropochodną. Izomer B poddany reakcji monochlorowania w obecności światła, a następnie – reakcji z wodnym roztworem KOH, tworzy alkohol drugorzędowy.
Uzupełnij schemat ciągu przemian prowadzonych od związku B do alkoholu. Związki organiczne przedstaw za pomocą wzorów półstrukturalnych (grupowych) albo uproszczonych.
Zapis numeru etapu mechanizmu dehydratacji alkoholi, który decyduje o szybkości powstawania alkenu z alkoholu. Zadanie 44.1. Informator CKE chemia 2023 rozszerzony (1 punkt)
Dehydratacja (odwodnienie) alkoholi – reakcja, w wyniku której, w obecności kwasu, z alkoholu otrzymuje się alken – przebiega według mechanizmu obejmującego trzy etapy. Początkowo (etap I) powstaje protonowana forma alkoholu, następnie zachodzą jej powolna
dysocjacja (etap II) z utworzeniem karbokationu oraz szybkie odszczepienie protonu od sąsiedniego atomu węgla z utworzeniem alkenu (etap III).
Opisany proces można zilustrować schematem:
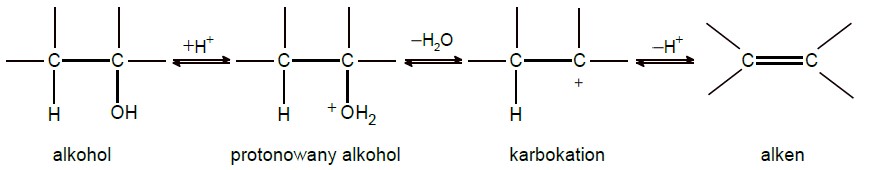
Wiązanie podwójne w alkenie powstającym podczas dehydratacji, będącym głównym produktem reakcji, znajduje się często w innym miejscu niż wynikałoby to z położenia grupy –OH w substracie. Dzieje się tak dlatego, że powstający karbokation ulega przegrupowaniu polegającemu na przeniesieniu atomu wodoru lub grupy alkilowej od sąsiedniego atomu węgla z jednoczesnym przemieszczeniem się ładunku dodatniego. Takie przegrupowanie zachodzi zawsze wtedy, gdy może ono spowodować powstanie trwalszego karbokationu, czyli takiego, w którym ładunek dodatni znajduje się na atomie węgla o możliwie najwyższej rzędowości.
Na podstawie: R.T. Morrison, R.N. Boyd, Chemia organiczna, Warszawa 1996.
Napisz numer tego etapu opisanego mechanizmu dehydratacji alkoholi, który decyduje o szybkości powstawania alkenu z alkoholu.