Obliczanie procentowej zawartości glinu w masie próbki. Zadanie 8. Arkusz CKE chemia próbny grudzień 2022 rozszerzony (2 punkty)
Przygotowano dwa zestawy laboratoryjne umożliwiające pomiar objętości gazu wydzielonego w reakcji metali z kwasem solnym. W kolbie jednego zestawu umieszczono próbkę mieszaniny wiórków magnezu i miedzi w stosunku molowym 8 : 3, a w kolbie drugiego zestawu – próbkę o takiej samej masie, ale złożoną z wiórków glinu i srebra. Do kolb wprowadzono nadmiar kwasu solnego i stwierdzono, że objętość wydzielonego gazu była taka sama w obu zestawach.
Oblicz zawartość glinu w % masowych w mieszaninie wiórków użytej w doświadczeniu. Przyjmij wartości mas molowych: MMg = 24 g∙mol–1 , MCu = 64 g∙mol–1 , MAl = 27 g∙mol–1 , MAg = 108 g∙mol–1 .
Wybór metalu wykorzystanego do przeprowadzenia eksperymentu. Zadanie 9. Arkusz CKE chemia próbny grudzień 2022 rozszerzony (1 punkt)
Badano reakcje stężonego kwasu azotowego(V) z metalami: z cynkiem, z glinem, z magnezem oraz ze srebrem. Jedno z przeprowadzonych doświadczeń pokazano na zdjęciu.

Wskaż metal, który znajduje się w probówce z kwasem pokazanej na zdjęciu, i uzasadnij swój wybór. Symbol metalu: Uzasadnienie:
Wybór wzoru soli użytej w doświadczeniu. Zadanie 10. Arkusz CKE chemia próbny grudzień 2022 rozszerzony (2 punkty)
Chlorek, bromek i jodek ołowiu(II) są solami trudno rozpuszczalnymi w wodzie. Chlorek i bromek mają barwę białą, a jodek jest żółty. Do 5,0 cm3 nasyconego roztworu chlorku ołowiu(II) dodano 2,5 cm3 roztworu pewnej soli i zaobserwowano efekt pokazany na zdjęciu.

Spośród poniższych soli wybierz tę, której roztwór mógł być użyty w tym doświadczeniu, i zaznacz jej wzór. Oblicz, jakie powinno być NaCl AgI KBr NaI Pb(NO3)2
minimalne stężenie molowe użytego roztworu tej soli, żeby wystąpił zaobserwowany efekt.
Rysowanie wykresu zależności rozpuszczalności od temperatury oraz obliczanie stężenia procentowego roztworu. Zadanie 11.1. Arkusz CKE chemia próbny grudzień 2022 rozszerzony (2 punkty)
W poniższej tabeli zamieszczono dane dotyczące rozpuszczalności substancji X w wodzie, a na wykresie przedstawiono krzywą zależności rozpuszczalności substancji Y w wodzie.
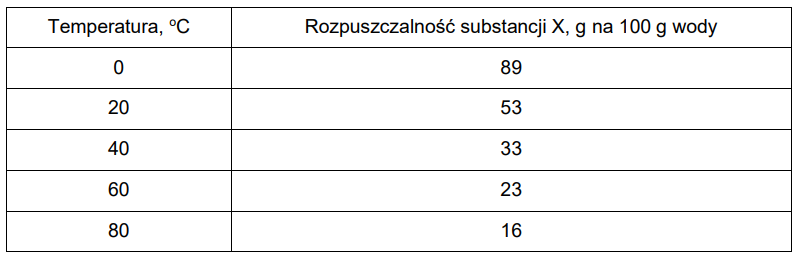
Narysuj na wykresie krzywą rozpuszczalności substancji X i wyznacz wartość temperatury, w której substancje X i Y mają taką samą rozpuszczalność. Oblicz stężenie procentowe nasyconego roztworu substancji X lub Y w tej temperaturze. Substancje X i Y mają taką samą rozpuszczalność w temperaturze: oC.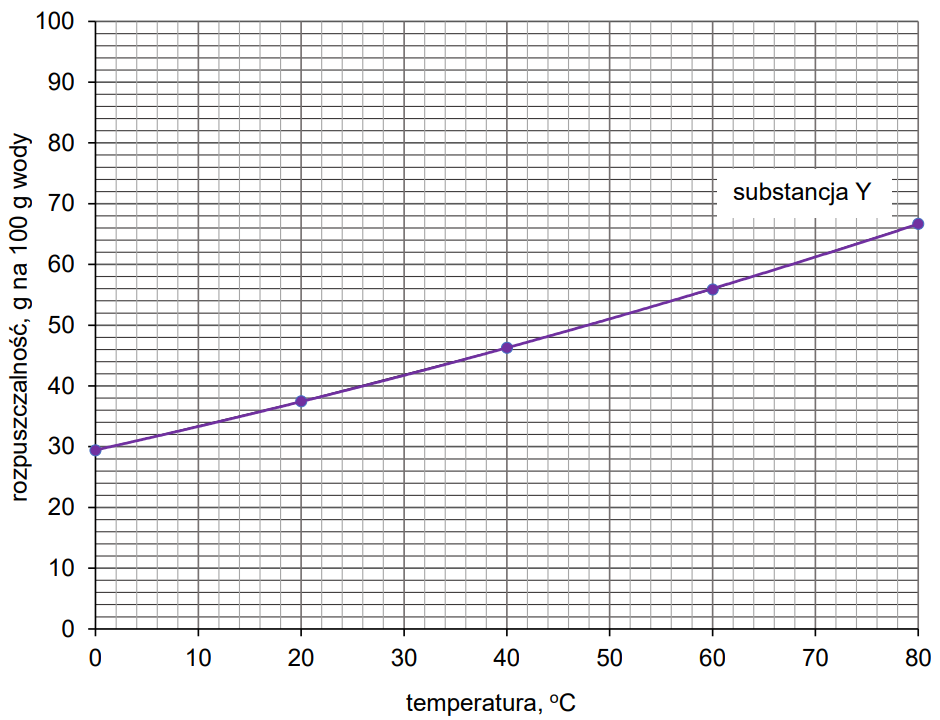
Wybór właściwych substancji z uzasadnieniem. Zadanie 11.2. Arkusz CKE chemia próbny grudzień 2022 rozszerzony (2 punkty)
W poniższej tabeli zamieszczono dane dotyczące rozpuszczalności substancji X w wodzie, a na wykresie przedstawiono krzywą zależności rozpuszczalności substancji Y w wodzie.


Spośród wymienionych niżej substancji wybierz tę, która była oznaczona symbolem X, oraz tę, która była oznaczona symbolem Y. Napisz ich wzory i uzasadnij swój wybór. O2 AgBr NH3 H2 NH4Cl CaCO3 Wzór substancji X: Uzasadnienie: Wzór substancji Y: Uzasadnienie:
Zapis cząsteczkowego oraz jonowego równania reakcji chemicznej. Zadanie 12.1. Arkusz CKE chemia próbny grudzień 2022 rozszerzony (2 punkty)
Przeprowadzono dwa doświadczenia.
Doświadczenie I: Uczeń strącił osad Fe(OH)2, a następnie dodał trochę wody utlenionej (wodnego roztworu H2O2 o stężeniu 3%) i zauważył, że barwa osadu zmieniła się na rdzawobrązową (reakcja 1.).
Doświadczenie II: Uczeń przygotował zielony roztwór Na3[Cr(OH)6], a następnie dodał trochę H2O2 i stwierdził, że barwa roztworu zmieniła się na żółtą (reakcja 2.). Na podstawie wyników tych doświadczeń uczeń sformułował hipotezę:
H2O2 w reakcjach utleniania-redukcji zawsze zachowuje się jak utleniacz.
Napisz równania reakcji przebiegających w opisanych doświadczeniach: Reakcja 1.: Reakcja 2.:
• w formie cząsteczkowej – równanie reakcji 1.
• w formie jonowej skróconej – równanie reakcji 2.
Rozstrzygnięcie z uzasadnieniem, czy postawiona hipoteza jest właściwa. Zadanie 12.2. Arkusz CKE chemia próbny grudzień 2022 rozszerzony (1 punkt)
Przeprowadzono dwa doświadczenia.
Doświadczenie I: Uczeń strącił osad Fe(OH)2, a następnie dodał trochę wody utlenionej (wodnego roztworu H2O2 o stężeniu 3%) i zauważył, że barwa osadu zmieniła się na rdzawobrązową (reakcja 1.).
Doświadczenie II: Uczeń przygotował zielony roztwór Na3[Cr(OH)6], a następnie dodał trochę H2O2 i stwierdził, że barwa roztworu zmieniła się na żółtą (reakcja 2.). Na podstawie wyników tych doświadczeń uczeń sformułował hipotezę:
H2O2 w reakcjach utleniania-redukcji zawsze zachowuje się jak utleniacz.
Nauczyciel zaproponował, żeby w celu weryfikacji postawionej hipotezy sprawdzić, czy woda utleniona reaguje z jonami manganianowymi(VII). Doświadczenie przeprowadzono. Na zdjęciach obok pokazano, jak zmieniał się wygląd zawartości probówki z roztworem KMnO4, gdy dodano do niego H2O2.

Rozstrzygnij, czy wynik doświadczenia potwierdza uczniowską hipotezę. Uzasadnij swoją odpowiedź – zinterpretuj zmiany zaobserwowane w trakcie doświadczenia. Rozstrzygnięcie: Uzasadnienie:
Rozstrzygnięcie z uzasadnieniem czy można użyć nadmiaru roztworu NaOH. Zadanie 13. Arkusz CKE chemia próbny grudzień 2022 rozszerzony (1 punkt)
W celu skutecznego usunięcia jonów z roztworu stosuje się często metodę strąceniową, w której odczynnik strącający jest dodawany w nadmiarze.
Rozstrzygnij, czy w ten sposób można usunąć jony glinu z roztworu jego soli, gdy odczynnikiem strącającym będzie roztwór NaOH. Uzasadnij swoją odpowiedź. Rozstrzygnięcie: Uzasadnienie:
Zapis wzorów tlenków. Zadanie 14.1. Arkusz CKE chemia próbny grudzień 2022 rozszerzony (1 punkt)
W trzech probówkach oznaczonych numerami 1, 2, 3, znajdowała się woda z dodatkiem oranżu metylowego. Do każdej z tych probówek wprowadzono małą porcję jednego z tlenków wybranych z poniższego zbioru:
Na2O SiO2 P4O10 CuO
Zawartość każdej z probówek wymieszano i pozostawiono na pewien czas.

Uzupełnij tabelę. Wpisz wzory tlenków wprowadzonych do probówek 1 i 2.
Zapisz równania reakcji w formie cząsteczkowej. Zadanie 14.2. Arkusz CKE chemia próbny grudzień 2022 rozszerzony (1 punkt)
W trzech probówkach oznaczonych numerami 1, 2, 3, znajdowała się woda z dodatkiem oranżu metylowego. Do każdej z tych probówek wprowadzono małą porcję jednego z tlenków wybranych z poniższego zbioru:
Na2O SiO2 P4O10 CuO
Zawartość każdej z probówek wymieszano i pozostawiono na pewien czas.

Napisz w formie cząsteczkowej równanie reakcji, której produkt spowodował zmianę barwy oranżu metylowego w probówce 3.
Obliczanie stężenia pary wodnej w stanie równowagi. Zadanie 15. Arkusz CKE chemia próbny grudzień 2022 rozszerzony (2 punkty)
W wysokiej temperaturze tlenki żelaza można zredukować wodorem do metalicznego żelaza. Redukcja tlenku Fe3O4 przebiega zgodnie z równaniem:
Fe3O4 (s) + 4H2 (g) ⇄ 3Fe (s) + 4H2O (g)
Z reaktora o pojemności 8,0 dm3 , zawierającego 420 g tlenku Fe3O4, odpompowano powietrze i wprowadzono 6,0 g wodoru. Zawartość reaktora ogrzano do temperatury 𝑇, w której stała równowagi powyższej reakcji wynosi 0,20.
Oblicz stężenie pary wodnej w reaktorze po ustaleniu się stanu równowagi oraz masę otrzymanego żelaza.
Wybór właściwych określeń z nawiasów dotyczących kinetyki reakcji. Zadanie 16.1. Arkusz CKE chemia próbny grudzień 2022 rozszerzony (1 punkt)
Badano kinetykę reakcji utleniania jonów bromkowych jonami bromianowymi(V) w środowisku kwasowym, która przebiega zgodnie z równaniem:
5Br– + BrO3– + 6H+ → 3Br2 + 3H2O
Na podstawie pomiarów kinetycznych ustalono następującą zależność między szybkością tej reakcji a stężeniami reagentów:
𝑣 = 𝑘 ⸱ [Br–] ⸱ [BrO3–] ⸱ [H+]2
Stała szybkości reakcji w zależności od postaci równania kinetycznego może mieć różny wymiar. Niżej przedstawiono przykładowe wyrażenia oznaczone literami A–D.
![]()
Uzupełnij poniższe zdania. Wybierz i zaznacz jedną odpowiedź spośród podanych w każdym nawiasie. Stała szybkości reakcji utleniania jonów bromkowych jonami bromianowymi(V) ma jednostkę oznaczoną literą (A / B / C / D). Jedno z podanych wyrażeń nie może być jednostką stałej szybkości reakcji. To wyrażenie oznaczono literą (A / B / C / D).
Obliczanie jak zmieni się szybkość reakcji w wyniku zmiany pH roztworu. Zadanie 16.2. Arkusz CKE chemia próbny grudzień 2022 rozszerzony (1 punkt)
Badano kinetykę reakcji utleniania jonów bromkowych jonami bromianowymi(V) w środowisku kwasowym, która przebiega zgodnie z równaniem:
5Br– + BrO3– + 6H+ → 3Br2 + 3H2O
Na podstawie pomiarów kinetycznych ustalono następującą zależność między szybkością tej reakcji a stężeniami reagentów:
𝑣 = 𝑘 ⸱ [Br–] ⸱ [BrO3–] ⸱ [H+]2
Oblicz, jak zmieni się szybkość opisanej reakcji, jeżeli początkowe pH roztworu będzie wyższe o 𝟎,𝟑.
Zapis wniosku na podstawie przeprowadzonego doświadczenia z udziałem chloroformu. Zadanie 17. Arkusz CKE chemia próbny grudzień 2022 rozszerzony (1 punkt)
Na zdjęciu obok pokazano dwuetapowe doświadczenie, podczas którego do probówki wprowadzono kilka cm3 chloroformu (CHCl3) oraz wodę bromową (etap 1.), a następnie ciecze wymieszano i pozostawiono na pewien czas (etap 2.).

Przedstaw wniosek z pokazanego doświadczenia dotyczący porównania gęstości wody bromowej i chloroformu. Nazwij proces, który spowodował zmianę wyglądu zawartości probówki po wymieszaniu i ponownym rozdzieleniu się cieczy. Gęstość chloroformu jest niż gęstość wody bromowej. Nazwa procesu:
Rozstrzygnięcie, czy dane rodzaje jonów można utlenić kwasem azotowym(V). Zadanie 18. Arkusz CKE chemia próbny grudzień 2022 rozszerzony (1 punkt)
Jedna z metod wykrywania obecności jonów bromkowych albo jodkowych w roztworze polega na utlenieniu ich do wolnego bromu albo jodu.
Rozstrzygnij, czy zarówno jony bromkowe, jak i jony jodkowe można utlenić za pomocą kwasu azotowego(V). Uzasadnij swoją odpowiedź. W uzasadnieniu odnieś się do wartości odpowiednich potencjałów standardowych. Rozstrzygnięcie: jony bromkowe: jony jodkowe: Uzasadnienie:

