Zapis równania reakcji chemicznej z udziałem wybranego reagenta oraz wskazanie nazwy produktu. Zadanie 31. Arkusz CKE chemia próbny grudzień 2022 rozszerzony (1 punkt)
Wanilina jest popularną substancją zapachową stosowaną w przemyśle spożywczym i kosmetycznym. Strukturę cząsteczki tego związku przedstawia wzór I.
W jednej z metod otrzymywania waniliny produktem pośrednim jest związek opisany wzorem II.
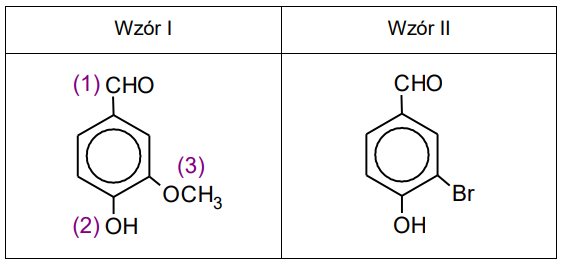
Grupa oznaczona cyfrą (3) może występować w formie anionu w związku, który jest produktem reakcji metanolu z jednym z wymienionych niżej reagentów:
NaOH CH3COONa Na Na2CO3
Wybierz odpowiedni reagent i napisz w formie cząsteczkowej równanie tej reakcji. Napisz nazwę jej organicznego produktu. Równanie reakcji: Nazwa produktu:
Rozstrzygnięcie z uzasadnieniem, czy wskazany związek chemiczny jest głównym produktem reakcji chemicznej. Zadanie 32. Arkusz CKE chemia próbny grudzień 2022 rozszerzony (1 punkt)
Wanilina jest popularną substancją zapachową stosowaną w przemyśle spożywczym i kosmetycznym. Strukturę cząsteczki tego związku przedstawia wzór I.
W jednej z metod otrzymywania waniliny produktem pośrednim jest związek opisany wzorem II.

Związek oznaczony wzorem II otrzymuje się w reakcji bromowania 4-hydroksybenzaldehydu (aldehydu 4-hydroksybenzoesowego).
Rozstrzygnij, czy związek opisany wzorem II jest głównym czy ubocznym produktem tej reakcji. Odpowiedź uzasadnij. W uzasadnieniu odwołaj się do wpływu kierującego podstawników. Rozstrzygnięcie: Uzasadnienie:
Rysowanie wzoru etylowaniliny. Zadanie 33. Arkusz CKE chemia próbny grudzień 2022 rozszerzony (1 punkt)
Wanilina jest popularną substancją zapachową stosowaną w przemyśle spożywczym i kosmetycznym. Strukturę cząsteczki tego związku przedstawia wzór I.
W jednej z metod otrzymywania waniliny produktem pośrednim jest związek opisany wzorem II.

Silniejszym środkiem zapachowym od waniliny, ale o podobnym aromacie, jest związek nazywany etylowaniliną. Położenie atomów tlenu względem pierścienia aromatycznego jest takie samo w obu tych związkach, natomiast ich masy cząsteczkowe różnią się o 14 u.
Uzupełnij poniższy wzór tak, aby przedstawiał cząsteczkę etylowaniliny.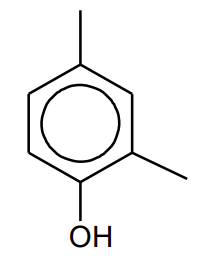
Zapis wzoru tripeptydu spełniającego określone warunki. Zadanie 34. Arkusz CKE chemia próbny grudzień 2022 rozszerzony (1 punkt)
Pewien tripeptyd zbudowany z aminokwasów białkowych zawiera w każdej ze swoich cząsteczek cztery atomy tlenu, cztery atomy azotu i dwa asymetryczne atomy węgla. Dwa aminokwasy wchodzące w skład tego tripeptydu mają 4-węglowe łańcuchy boczne. Reszty aminokwasów są uporządkowane zgodnie ze wzrostem ich mas cząsteczkowych, czyli największą masę cząsteczkową ma aminokwas z wolną grupą karboksylową.
Napisz wzór tripeptydu spełniającego opisane warunki. Użyj trzyliterowych kodów aminokwasów. Pamiętaj, że z lewej strony umieszcza się kod aminokwasu, którego reszta zawiera wolną grupę aminową połączoną z atomem węgla α.
Ocena poprawności zdań dotyczących reakcji z udziałem monosacharydów. Zadanie 35. Arkusz CKE chemia próbny grudzień 2022 rozszerzony (1 punkt)
Jednym z procesów, którym mogą ulegać cukry, jest skracanie łańcucha węglowego. Jeżeli aldoheksozę podda się utlenieniu za pomocą wody bromowej, otrzymany kwas będzie można przekształcić w aldopentozę. Przykład takiego ciągu przemian przedstawiono na poniższym schemacie.
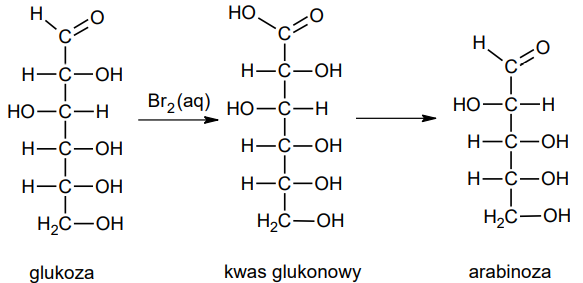
Oceń prawdziwość poniższych zdań. Zaznacz P, jeśli zdanie jest prawdziwe, albo F – jeśli jest fałszywe. 1. Schemat przedstawia przemianę D-glukozy w L-arabinozę. 2. Podczas przemiany glukozy w arabinozę zmienia się liczba asymetrycznych atomów węgla.
Zachowanie się fenolu wobec roztworu chlorku żelaza(III)
W filmie przedstawiono zmiany (wraz z komentarzami) jakie towarzyszą reakcji zachodzącej po wprowadzeniu roztworu fenolu do wodnego roztworu chlorku żelaza(III).
© dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określenie symboli pierwiastków chemicznych, położenia w układzie okresowym oraz stopni utlenienia. Zadanie 1.1. Arkusz CKE chemia maj 2022 rozszerzony (2 punkty)
Z dwóch pierwiastków, które umownie oznaczono literami X i E, powstają wodorki o wzorach XH3 i EH3. Atomy każdego z tych pierwiastków mają tyle elektronów niewalencyjnych, ile wynosi liczba nukleonów w atomie izotopu 28Si. W stanie podstawowym atomy pierwiastka E mają większą liczbę elektronów niesparowanych niż atomy pierwiastka X.
Uzupełnij poniższą tabelę. Wpisz symbole pierwiastków X i E, symbol bloku konfiguracyjnego, do którego należy każdy z pierwiastków, oraz ich maksymalne stopnie utlenienia.
Zapis walencyjnej konfiguracji elektronowej w systemie klatkowym. Zadanie 1.2. Arkusz CKE chemia maj 2022 rozszerzony (1 punkt)
Z dwóch pierwiastków, które umownie oznaczono literami X i E, powstają wodorki o wzorach XH3 i EH3. Atomy każdego z tych pierwiastków mają tyle elektronów niewalencyjnych, ile wynosi liczba nukleonów w atomie izotopu 28Si. W stanie podstawowym atomy pierwiastka E mają większą liczbę elektronów niesparowanych niż atomy pierwiastka X.
Napisz fragment konfiguracji elektronowej atomu w stanie podstawowym pierwiastka E opisujący rozmieszczenie elektronów walencyjnych na podpowłokach – zastosuj schemat klatkowy. Pod schematem napisz numer powłoki i symbole podpowłok.
Przyporządkowanie długości promieni atomowych pierwiastkom chemicznym. Zadanie 2. Arkusz CKE chemia maj 2022 rozszerzony (1 punkt)
W poniższej tabeli podano wartości promieni atomowych r1 , r2 , r3 i r4 atomów czterech pierwiastków.
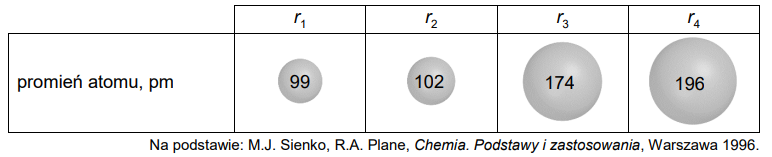
Uzupełnij poniższą tabelę. Na podstawie zmienności promieni atomów w grupach i okresach przyporządkuj wymienionym pierwiastkom wartości promieni atomowych ich atomów.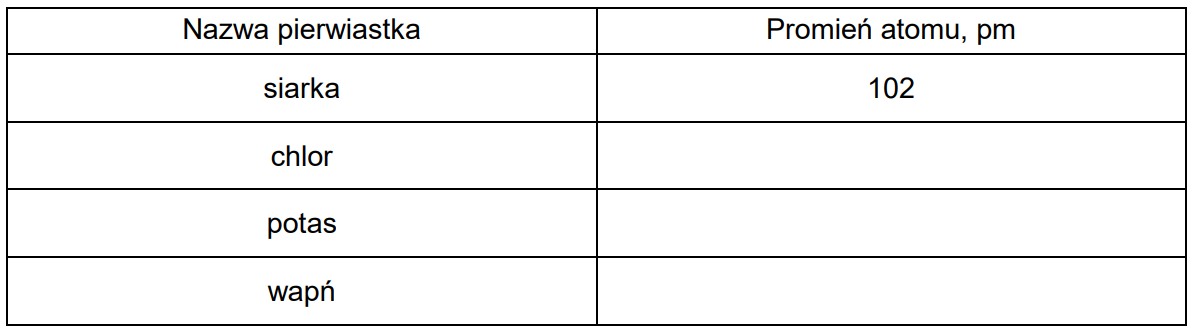
Rysowanie kreskowego wzoru elektronowego chlorku boru. Zadanie 3.1. Arkusz CKE chemia maj 2022 rozszerzony (1 punkt)
Bor tworzy z chlorem związek o wzorze BCl3, występujący w postaci płaskich trójkątnych cząsteczek. Te cząsteczki mogą łączyć się z innymi drobinami zawierającymi wolne pary elektronowe. Chlorek boru reaguje z wodą i podczas tej reakcji tworzą się H3BO3 (kwas ortoborowy) oraz HCl.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2004.
Narysuj wzór elektronowy chlorku boru. Uwzględnij wolne pary elektronowe.
Wybór wzorów drobin mogących łączyć się z chlorkiem boru oraz uzasadnienie wyboru. Zadanie 3.2. Arkusz CKE chemia maj 2022 rozszerzony (1 punkt)
Bor tworzy z chlorem związek o wzorze BCl3, występujący w postaci płaskich trójkątnych cząsteczek. Te cząsteczki mogą łączyć się z innymi drobinami zawierającymi wolne pary elektronowe. Chlorek boru reaguje z wodą i podczas tej reakcji tworzą się H3BO3 (kwas ortoborowy) oraz HCl.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2004.
Spośród wymienionych drobin: Cl– NH4+ CH4 NH3 wybierz te, które mogą łączyć się z chlorkiem boru, i napisz ich wzory. Wyjaśnij, dlaczego cząsteczki chlorku boru mają zdolność do tworzenia wiązań z tymi drobinami. Odwołaj się do struktury elektronowej cząsteczek chlorku boru. Z chlorkiem boru mogą łączyć się: Cząsteczki chlorku boru mają zdolność do tworzenia wiązań z wybranymi drobinami, ponieważ
Zapis równania reakcji chlorku boru z wodą. Zadanie 3.3. Arkusz CKE chemia maj 2022 rozszerzony (1 punkt)
Bor tworzy z chlorem związek o wzorze BCl3, występujący w postaci płaskich trójkątnych cząsteczek. Te cząsteczki mogą łączyć się z innymi drobinami zawierającymi wolne pary elektronowe. Chlorek boru reaguje z wodą i podczas tej reakcji tworzą się H3BO3 (kwas ortoborowy) oraz HCl.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2004.
Napisz w formie cząsteczkowej równanie reakcji chlorku boru z wodą.
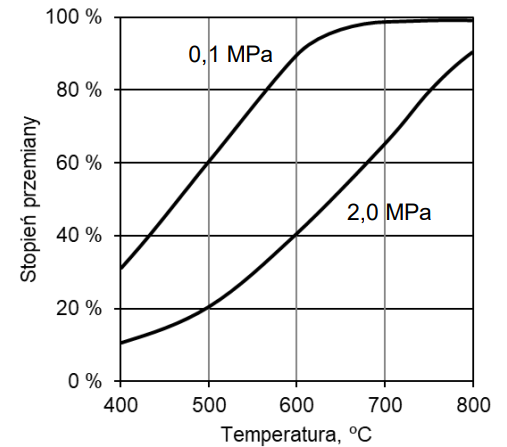
Wybór numeru reakcji wraz z uzasadnieniem na podstawie wykresu przedstawiającego zależność stopnia przemiany od temperatury. Zadanie 4.1. Arkusz CKE chemia maj 2022 rozszerzony (1 punkt)
Gaz syntezowy, czyli mieszanina CO i H2, jest otrzymywany w przemyśle różnymi metodami. Niżej podano równania dwóch reakcji, w których powstaje taka mieszanina.
I CH4 + CO2 → 2CO + 2H2 ∆H < 0
II CH4 + H2O → CO + 3H2 ∆H > 0
Na poniższym wykresie przedstawiono zależność stopnia przemiany metanu od temperatury dla dwóch różnych wartości ciśnienia dla jednej z tych reakcji. Stopień przemiany metanu jest miarą wydajności reakcji – im większy stopień przemiany, tym większa wydajność reakcji.
Na podstawie: M. Pańczyk, T. Borowiecki, Otrzymywanie i zastosowanie gazu syntezowego, Lublin 2013.
Napisz numer reakcji (I albo II), do której odnosi się powyższy wykres stopnia przemiany metanu. Odpowiedź uzasadnij – uwzględnij efekt energetyczny reakcji. Numer reakcji: Uzasadnienie:

