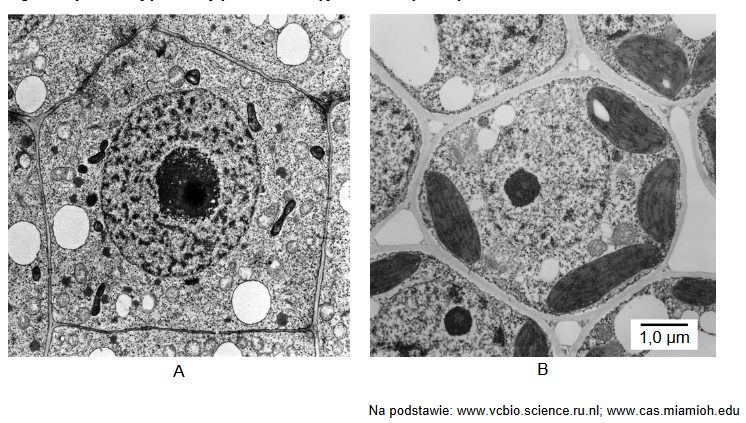
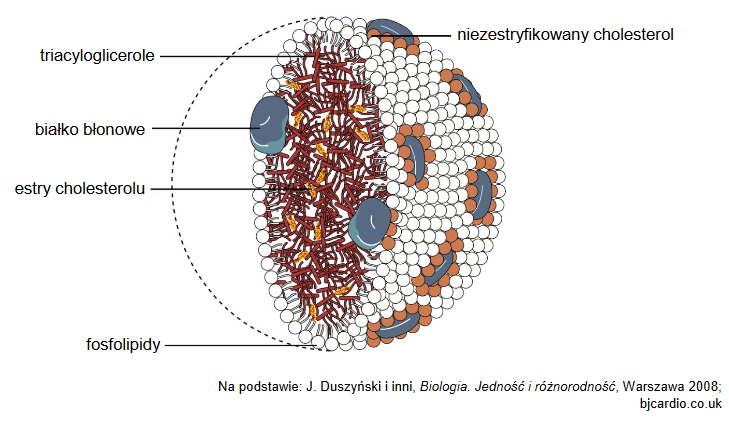
rozpoznawanie elementów komórki na mikrofotografii
Na zdjęciu A, wykonanym za pomocą transmisyjnego mikroskopu elektronowego, widoczna jest struktura oznaczona literą X. Ta struktura występuje w większości komórek zwierzęcych. Na rysunku B przedstawiono schematycznie budowę tej struktury.

Podaj nazwę struktury oznaczonej literą X oraz określ jej funkcję w komórce.
Nazwa struktury X:
Funkcja w komórce:
Zachowanie się gliceryny wobec alkalicznej zawiesiny wodorotlenku miedzi(II)
W filmie przedstawiono zmiany (wraz z komentarzami) jakie towarzyszą reakcji zachodzącej po wprowadzeniu gliceryny do alkalicznej zawiesiny wodorotlenku miedzi(II).
© dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wskazanie symboli pierwiastków chemicznych na podstawie fotografii roztworu oraz opisu. Zadanie 1.1. Arkusz CKE chemia próbny grudzień 2022 rozszerzony (1 punkt)
Na zdjęciu obok przedstawiono wodny roztwór soli, w skład której wchodzą pierwiastki X1, X2 i X3. Dwa z nich są w stanie wolnym metalami i należą do tego samego okresu, a jeden jest niemetalem i leży w innym okresie. Masy atomowe tych trzech pierwiastków, zaokrąglone do liczb całkowitych, spełniają zależność: MX1 + MX2 = MX3.

Atom pierwiastka X3 ma na zewnętrznej powłoce dwa razy więcej elektronów niż atom pierwiastka X2, a atom pierwiastka X1 ma na zewnętrznej powłoce dwa razy więcej niesparowanych elektronów niż atom pierwiastka X2.
Zidentyfikuj pierwiastki X1, X2 oraz X3. Napisz ich symbole chemiczne. X1: X2: X3:
Przypisywanie wartości liczb kwantowych elektronom niesparowanym. Zadanie 1.2. Arkusz CKE chemia próbny grudzień 2022 rozszerzony (1 punkt)
Na zdjęciu obok przedstawiono wodny roztwór soli, w skład której wchodzą pierwiastki X1, X2 i X3. Dwa z nich są w stanie wolnym metalami i należą do tego samego okresu, a jeden jest niemetalem i leży w innym okresie. Masy atomowe tych trzech pierwiastków, zaokrąglone do liczb całkowitych, spełniają zależność: MX1 + MX2 = MX3.

Atom pierwiastka X3 ma na zewnętrznej powłoce dwa razy więcej elektronów niż atom pierwiastka X2, a atom pierwiastka X1 ma na zewnętrznej powłoce dwa razy więcej niesparowanych elektronów niż atom pierwiastka X2.
Uzupełnij poniższą tabelę. Wpisz wartości liczb kwantowych odpowiadających niesparowanym elektronom w atomach (w stanie podstawowym) pierwiastków X1 i X3.
Ocena poprawności zdań. Zadanie 2. Arkusz CKE chemia próbny grudzień 2022 rozszerzony (1 punkt)
Oceń prawdziwość poniższych zdań. Zaznacz P, jeśli zdanie jest prawdziwe, albo F – jeśli jest fałszywe.
1. Atomy tego samego pierwiastka mogą się różnić pod względem masy atomowej. 2. Atomy różnych pierwiastków mogą mieć taką samą liczbę masową.
Obliczanie stałej Avogadra na podstawie naturalnych rozpadów promieniotwórczych. Zadanie 3.1. Arkusz CKE chemia próbny grudzień 2022 rozszerzony (4 punkty)
Cząstki α emitowane przez jądra wielu promieniotwórczych izotopów ulegają zobojętnieniu elektronami z otoczenia, co prowadzi do powstania gazowego helu. Jeżeli rozpad promieniotwórczy zachodzi w układzie zamkniętym, ilość helu otrzymanego w taki sposób jest proporcjonalna do liczby wyemitowanych cząstek α. Ta zależność stała się podstawą jednej z pierwszych metod wyznaczania stałej Avogadra. Zmierzono aktywność radu 226Ra i stwierdzono, że 1,0 g tego izotopu w ciągu sekundy emituje 3,4 ⸱ 1010 cząstek α, co powoduje jego przemianę w radon 222Rn. Następnie z izotopu 222Rn, w wyniku ciągu kilku szybkich przemian promieniotwórczych α i β– , powstaje ołów 210Pb. Dalszy rozpad tego nuklidu nie wpływa na przebieg eksperymentu.
Próbkę zawierającą 200 mg izotopu 226Ra zamknięto na 80 dni (6 912 000 s) w zbiorniku i po tym czasie stwierdzono, że powstało 7,0 mm3 helu (w przeliczeniu na warunki normalne). Można przyjąć, że aktywność radu 226Ra była stała w czasie trwania eksperymentu.
Oblicz stałą Avogadra na podstawie danych z opisanego eksperymentu. Przedstaw tok rozumowania. Rozwiązanie tego zadania dostępne jest nieodpłatnie pod poniższym linkiem:
Obliczanie liczby emitowanych cząstek beta minus. Zadanie 3.2. Arkusz CKE chemia próbny grudzień 2022 rozszerzony (1 punkt)
Cząstki α emitowane przez jądra wielu promieniotwórczych izotopów ulegają zobojętnieniu elektronami z otoczenia, co prowadzi do powstania gazowego helu. Jeżeli rozpad promieniotwórczy zachodzi w układzie zamkniętym, ilość helu otrzymanego w taki sposób jest proporcjonalna do liczby wyemitowanych cząstek α. Ta zależność stała się podstawą jednej z pierwszych metod wyznaczania stałej Avogadra. Zmierzono aktywność radu 226Ra i stwierdzono, że 1,0 g tego izotopu w ciągu sekundy emituje 3,4 ⸱ 1010 cząstek α, co powoduje jego przemianę w radon 222Rn. Następnie z izotopu 222Rn, w wyniku ciągu kilku szybkich przemian promieniotwórczych α i β– , powstaje ołów 210Pb. Dalszy rozpad tego nuklidu nie wpływa na przebieg eksperymentu.
Próbkę zawierającą 200 mg izotopu 226Ra zamknięto na 80 dni (6 912 000 s) w zbiorniku i po tym czasie stwierdzono, że powstało 7,0 mm3 helu (w przeliczeniu na warunki normalne). Można przyjąć, że aktywność radu 226Ra była stała w czasie trwania eksperymentu.
Oblicz, ile cząstek β– jest emitowanych w ciągu przemian jądra 226Ra w jądro 210Pb.
Rozszyfrowanie symbolu pierwiastka na podstawie konfiguracji elektronowej kationu. Zadanie 4. Arkusz CKE chemia próbny grudzień 2022 rozszerzony (1 punkt)
Niżej przedstawiono konfigurację elektronową kationu pewnego pierwiastka o ładunku 3+.
1s2 2s2 2p6 3s2 3p6 3d3
Wpisz symbol tego pierwiastka w miejscu na to przeznaczonym oraz uzupełnij poniższy schemat tak, aby przedstawiał konfigurację elektronową jego atomu w stanie podstawowym.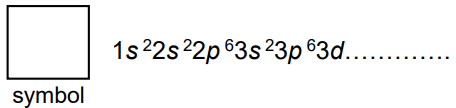
Przyporządkowanie odpowiednich oddziaływań oraz wiązań chemicznych do dwóch układów. Zadanie 5. Arkusz CKE chemia próbny grudzień 2022 rozszerzony (1 punkt)
Niżej wymieniono wybrane wiązania chemiczne i oddziaływania międzycząsteczkowe, którym przyporządkowano numery od 1 do 6.
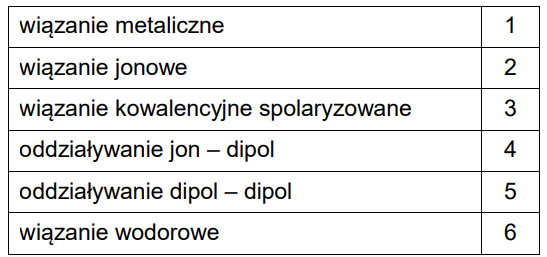
Porównaj dwa układy: stały azotan(V) potasu i rozcieńczony wodny roztwór tej soli, pod względem występujących w nich wiązań chemicznych i oddziaływań międzycząsteczkowych. Wpisz właściwe numery w odpowiednie kolumny tabeli. Uwzględnij wszystkie wiązania i oddziaływania występujące w każdym z tych układów.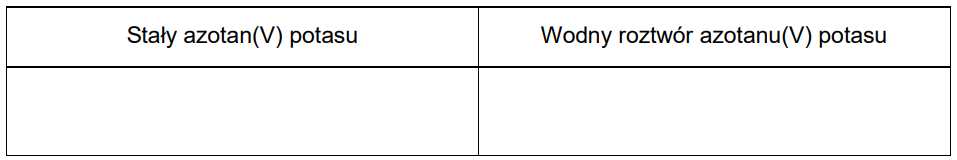
Przypisywanie typu kryształów do odpowiedniej substancji. Zadanie 6. Arkusz CKE chemia próbny grudzień 2022 rozszerzony (1 punkt)
Dwie substancje oznaczono umownie literami A i B. W poniższej tabeli przedstawiono podobieństwa i różnice we właściwościach tych substancji.
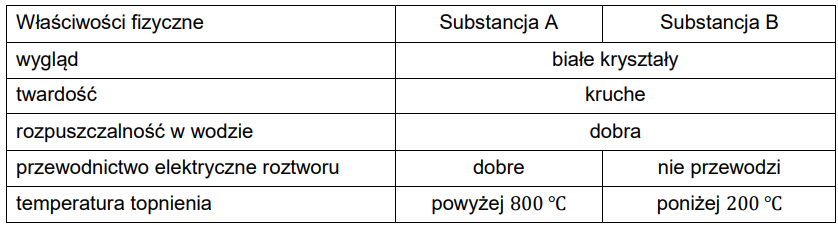
Określ rodzaje kryształów (metaliczne, jonowe, kowalencyjne, molekularne) tworzone przez badane substancje.
Rozstrzygnięcie na podstawie entalpii, czy reakcja spalania CO jest egzotermiczna. Zadanie 7. Arkusz CKE chemia próbny grudzień 2022 rozszerzony (1 punkt)
Rozstrzygnij, czy na podstawie wartości entalpii tworzenia CO oraz CO2 można stwierdzić, że reakcja spalania tlenku węgla(II) jest egzotermiczna. Uzasadnij swoją odpowiedź.
Rozstrzygnięcie: Uzasadnienie: