Obliczanie zmiany krotności szybkości reakcji w danym momencie jej przebiegu względem szybkości początkowej
Czas, w którym ilość substancji zmniejsza się o połowę nazywamy czasem połowicznej przemiany (przereagowania). W zależności od rzędowości reakcji, wyrażenie opisujące tę wielkość przyjmuje postać:
t1/2 = 0,693/k dla reakcji I-rzędu
t1/2 = 1/(k·Co) dla reakcji II-rzędu
t1/2 = 3/(2·k· Co2) dla reakcji III-rzędu
W podanych równaniach wielkość k jest stałą szybkości reakcji chemicznej, natomiast Co to początkowe stężenie substratu.
W stałej temperaturze T badano szybkość pewnej reakcji chemicznej biegnącej zgodnie z kinetyką I-rzędu. Wyniki eksperymentu zebrano w tabeli.
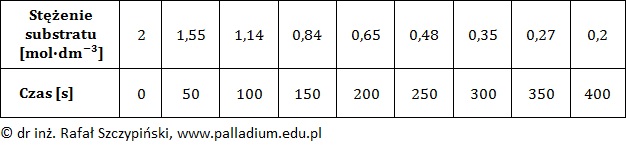
Opisana przemiana przebiegła według schematu:
2A(g) ⟶ 3B(g) + C(g)
Określ, jak zmieniła się szybkość tej reakcji w momencie wykonania ostatniego pomiaru, w stosunku do szybkości początkowej? Odpowiedź uzasadnij obliczeniami. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie stężeń substratów przy podanej wartości szybkości reakcji chemicznej
Przykładem prostej reakcji dwucząsteczkowej jest proces opisany równaniem:
NO(g) + O3(g) ⟶ NO2(g) + O2(g)
W pewnych warunkach stała szybkości tej reakcji ma wartość równą 2 dm3·mol-1·s-1. W warunkach tych, w reaktorze o pojemności 2 dm3 sporządzono gazową mieszaninę zawierającą 2 mole tlenku azotu(II) oraz 3 mole ozonu i zainicjowano reakcję chemiczną.
Jakie będą stężenia molowe obu substratów opisanej w informacji wprowadzającej reakcji, w momencie gdy jej szybkość będzie równa 0,12 mol·dm-3·s-1? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie równania kinetycznego oraz rzędowości reakcji chemicznej
Przykładem prostej reakcji dwucząsteczkowej jest proces opisany równaniem:
NO(g) + O3(g) ⟶ NO2(g) + O2(g)
W pewnych warunkach stała szybkości tej reakcji ma wartość równą 2 dm3·mol-1·s-1. W warunkach tych, w reaktorze o pojemności 2 dm3 sporządzono gazową mieszaninę zawierającą 2 mole tlenku azotu(II) oraz 3 mole ozonu i zainicjowano reakcję chemiczną.
Napisz równanie kinetyczne opisanej reakcji chemicznej i określ jej rzędowość względem każdego z substratów oraz całkowity rząd reakcji. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określenie rzędowości reakcji utleniania tlenku azotu(II) tlenem z wyjaśnieniem
Reakcję utleniania tlenku azotu(II) opisują następujące równania:
– stechiometryczne: 2NO(g) + O2(g) ⟶ 2NO2(g)
– kinetyczne: V = k ∙ C2NO ∙ Ctlen
Na podstawie: K.-H. Lautenschläger i inni, Nowoczesne kompendium chemii, Warszawa 2018.
Wyjaśnij, którego rzędu jest opisana reakcja chemiczna? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie jak zmieniłaby się szybkość reakcji utleniania tlenku azotu(II) po zmianie stężenia jednego substratu
Reakcję utleniania tlenku azotu(II) opisują następujące równania:
– stechiometryczne: 2NO(g) + O2(g) ⟶ 2NO2(g)
– kinetyczne: V = k ∙ C2NO ∙ Ctlen
Na podstawie: K.-H. Lautenschläger i inni, Nowoczesne kompendium chemii, Warszawa 2018.
Oblicz, jak zmieniłaby się szybkość opisanej reakcji chemicznej, jeśli przy niezmienionym stężeniu molowym tlenu zostałoby trzykrotnie zwiększone stężenie molowe tlenku azotu(II)? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie jak zmieniłaby się szybkość reakcji utleniania tlenku azotu(II) po zmniejszeniu ciśnienia
Reakcję utleniania tlenku azotu(II) opisują następujące równania:
– stechiometryczne: 2NO(g) + O2(g) ⟶ 2NO2(g)
– kinetyczne: V = k ∙ C2NO ∙ Ctlen
Na podstawie: K.-H. Lautenschläger i inni, Nowoczesne kompendium chemii, Warszawa 2018.
W temperaturze 25 oC pod ciśnieniem 1013 hPa przeprowadzono reakcję utleniania tlenku azotu(II) tlenem. Ustal na podstawie odpowiednich obliczeń, jak zmieniłaby się szybkość tej reakcji, gdyby przy zachowaniu stałej temperatury dokonano zmiany objętości przestrzeni reakcyjnej w taki sposób, aby ciśnienie wynosiło 810,4 hPa? Wynik podaj z dokładnością do trzech cyfr znaczących. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie ile razy powinno być większe stężenie tlenku azotu(II) aby reakcja przebiegła wielokrotnie szybciej
Reakcję utleniania tlenku azotu(II) opisują następujące równania:
– stechiometryczne: 2NO(g) + O2(g) ⟶ 2NO2(g)
– kinetyczne: V = k ∙ C2NO ∙ Ctlen
Na podstawie: K.-H. Lautenschläger i inni, Nowoczesne kompendium chemii, Warszawa 2018.
Oblicz, ile razy wyższe powinno być stężenie molowe tlenku azotu(II) przy niezmienionym stężeniu molowym tlenu, aby opisana reakcja przebiegła z 16-krotnie większą szybkością? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zależność szybkości reakcji chemicznej od pojemności reaktora
Biegnącą zgodnie z kinetyką pierwszego rzędu reakcję rozkładu tlenku azotu(V) przedstawia równanie stechiometryczne:
2N2O5(g) → 4NO(g) + 3O2(g)
Przeprowadzono rozkład 2 moli tlenku azotu(V) w dwóch reaktorach o różnej pojemności – 0,5 dm3 oraz 2 dm3.
Napisz równanie kinetyczne opisanego procesu i określ, w którym z reaktorów reakcja przebiegła z większą szybkością, w tej samej temperaturze? Odpowiedź uzasadnij obliczeniami. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie stężenia, przy jakim reakcja biegnie z taką samą szybkością, jak w innym roztworze
Szybkość reakcji chemicznych zależy od stężeń molowych reagujących ze sobą drobin (na przykład cząsteczek, jonów).
W dwóch zlewkach umieszczono roztwory kwasów o identycznej temperaturze i takiej samej objętości – w zlewce pierwszej 0,005-molowy kwas solny, natomiast w drugiej z nich 0,5-molowy kwas mrówkowy. Do każdej ze zlewek wrzucono taką samą ilość wiórek magnezowych i zaobserwowano zmiany świadczące o przebiegu reakcji chemicznej.
Jakie powinno być stężenie początkowe roztworu kwasu mrówkowego, aby w chwili rozpoczęcia reakcji jej szybkość była identyczna z szybkością reakcji z zastosowaniem 0,005-molowego roztworu kwasu solnego? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone

