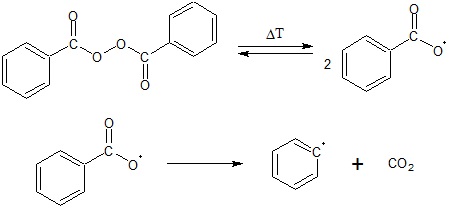
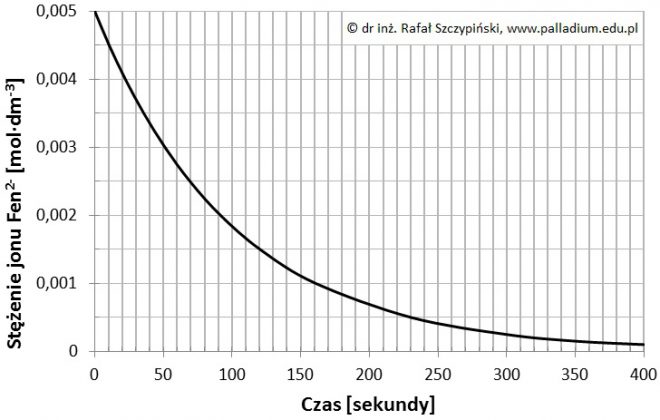
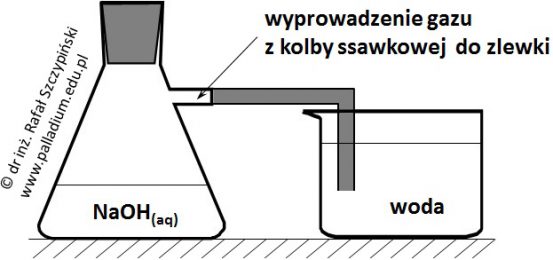
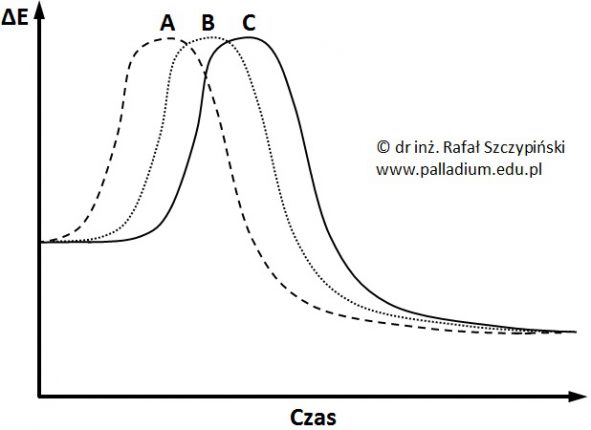
Określanie równania kinetycznego reakcji utleniania jonów jodkowych jonami nadtlenodisiarczanowymi
Proces utleniania jonów jodkowych jonami nadtlenodisiarczanowymi przebiega w środowisku wodnym zgodnie z równaniem stechiometrycznym:
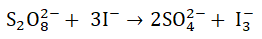
Na podstawie: P. W. Atkins, L. Jones, Chemia ogólna. Cząsteczki, materia, reakcje, Warszawa 2018.
Podczas wyznaczania rzędowości opisanej reakcji chemicznej względem każdego z substratów stwierdzono, że w wyniku dwukrotnego zwiększenia stężenia jonów jodkowych (przy stałym stężeniu jonów S2O82–) szybkość reakcji wzrasta dwukrotnie. Zmniejszając dwukrotnie stężenie jonów S2O82– (przy stałym stężeniu jonów jodkowych) szybkość reakcji utleniania jonów jodkowych dwukrotnie maleje.
Napisz równanie kinetyczne opisanego procesu. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
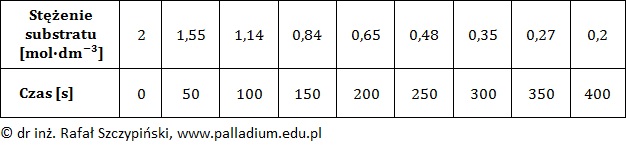
Wyznaczanie równania kinetycznego reakcji chemicznej na podstawie zmiany stężenia jednego substratu przy stałym stężeniu drugiego
Zbadano wpływ zmiany stężeń początkowych substratów A i B na szybkość pewnej reakcji chemicznej biegnącej według schematu:
3A(g) + 2B(g) → X(g)
Każde z doświadczeń przeprowadzono w temperaturze 400 K. Dane zebrano w tabeli.
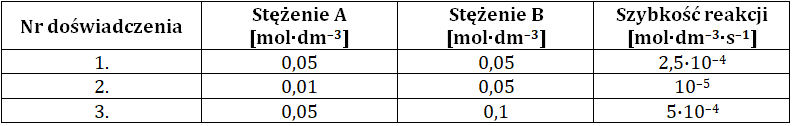
Uwzględniając wartość stałej szybkości opisanej reakcji chemicznej napisz jej równanie kinetyczne oraz określ całkowitą rzędowość. Równanie kinetyczne: …………………………………………..……… Rząd reakcji: …………………. Rozwiązanie tego zadania dostępne jest nieodpłatnie pod poniższym linkiem: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
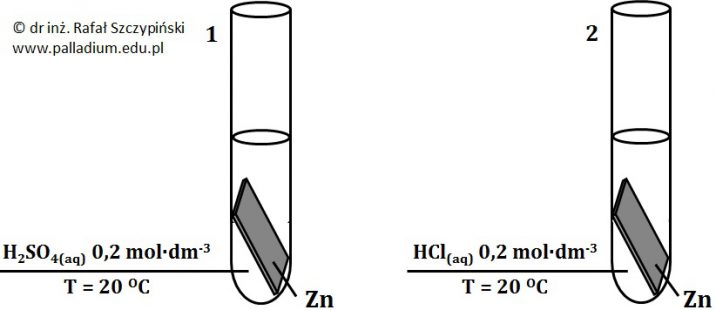
Wskazanie naczynia z kwasem, w którym reakcja przebiegła z większą szybkością
Szybkość reakcji chemicznych zależy od stężeń molowych reagujących ze sobą drobin (na przykład cząsteczek, jonów).
W dwóch zlewkach umieszczono roztwory kwasów o identycznej temperaturze i takiej samej objętości – w zlewce pierwszej 0,005-molowy kwas solny, natomiast w drugiej z nich 0,5-molowy kwas mrówkowy. Do każdej ze zlewek wrzucono taką samą ilość wiórek magnezowych i zaobserwowano zmiany świadczące o przebiegu reakcji chemicznej.
Na podstawie stosownych obliczeń określ, w którym z roztworów znajdujących się w zlewkach reakcja przebiegła z większą szybkością? Uzasadnij swoje stanowisko. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone