Zadanie 19. Wybór właściwego metalu. Doświadczenia chemiczne w zadaniach część 1. Rozdział 1 (1 punkt)
W probówce znajdował się roztwór kwasu azotowego(V) o nieznanym stężeniu, przy czym mogło ono wynosić 10% lub 64% masowych. Do zawartości naczynia wprowadzono następnie próbkę cynku i zaobserwowano zmiany widoczne na zamieszczonej fotografii.

Podkreśl nazwę tego z niżej wymienionych metali, który w reakcji z opisanym roztworem kwasu da taki sam efekt jak widoczny na fotografii. miedź, magnez, glin © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 20.1. Wybór właściwego kwasu. Doświadczenia chemiczne w zadaniach część 1. Rozdział 1 (1 punkt)
Przeprowadzono doświadczenie chemiczne według zamieszczonego schematu. W stężonym roztworze pewnego kwasu umieszczono wówczas aluminiową blaszkę, co ilustruje fotografia 1. Mieszaninę tę następnie rozcieńczono, co doprowadziło do uzyskania efektu widocznego na fotografii 2.
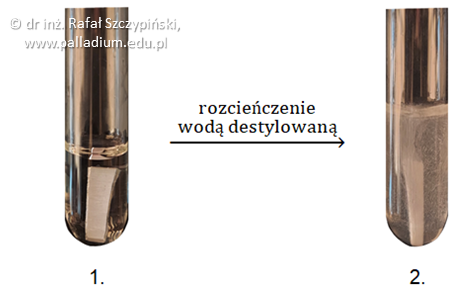
Podkreśl wzór sumaryczny tego kwasu, którego stężony roztwór wykorzystano podczas opisanego eksperymentu. HCl, HNO3, H2SO4 © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 20.2. Zapis równania reakcji chemicznej. Doświadczenia chemiczne w zadaniach część 1. Rozdział 1 (1 punkt)
Przeprowadzono doświadczenie chemiczne według zamieszczonego schematu. W stężonym roztworze pewnego kwasu umieszczono wówczas aluminiową blaszkę, co ilustruje fotografia 1. Mieszaninę tę następnie rozcieńczono, co doprowadziło do uzyskania efektu widocznego na fotografii 2.
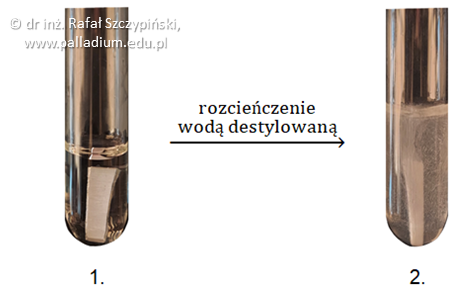
Napisz w formie jonowej skróconej równanie reakcji chemicznej, której objaw widoczny jest na fotografii 2. po rozcieńczeniu roztworu kwasu. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 20.3. Zapis nazwy pewnego zjawiska. Doświadczenia chemiczne w zadaniach część 1. Rozdział 1 (1 punkt)
Przeprowadzono doświadczenie chemiczne według zamieszczonego schematu. W stężonym roztworze pewnego kwasu umieszczono wówczas aluminiową blaszkę, co ilustruje fotografia 1. Mieszaninę tę następnie rozcieńczono, co doprowadziło do uzyskania efektu widocznego na fotografii 2.
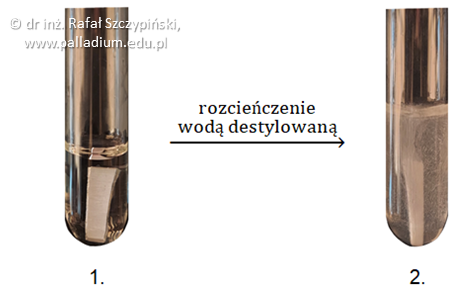
Podaj nazwę zjawiska będącego przyczyną braku objawu reakcji w probówce 1. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 21. Wybór właściwego piktogramu. Doświadczenia chemiczne w zadaniach część 1. Rozdział 1 (1 punkt)
W tabeli zebrano informacje na temat procentów masowych wybranych kwasów w ich mieszaninach z wodą.
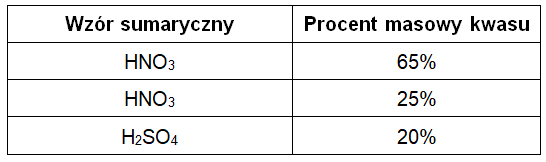
Zaznacz jeden spośród podanych piktogramów ostrzegawczych, który jest wspólny dla wszystkich trzech wymienionych mieszanin. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone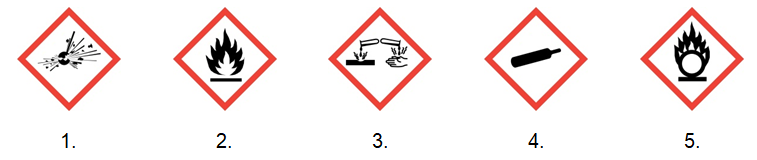
Zadanie 22.1. Rysowanie wzorów elektronowych kreskowych. Doświadczenia chemiczne w zadaniach część 1. Rozdział 1 (3 punkty)
W celu odróżnienia związków chemicznych – azotanu(III) sodu, jodku potasu oraz chlorku sodu, na ich próbki podziałano stężonym kwasem siarkowym(VI). Efekt przeprowadzonego doświadczenia ilustrują fotografie:

Narysuj kreskowe wzory elektronowe powstałych substancji chemicznych, które wywołały objawy reakcji widoczne na fotografiach 1.–3. 1.: 2.: 3.: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 22.2. Zapis równania reakcji chemicznej. Doświadczenia chemiczne w zadaniach część 1. Rozdział 1 (1 punkt)
W celu odróżnienia związków chemicznych – azotanu(III) sodu, jodku potasu oraz chlorku sodu, na ich próbki podziałano stężonym kwasem siarkowym(VI). Efekt przeprowadzonego doświadczenia ilustrują fotografie:

Do zawartości 2. probówki wprowadzono zasadę potasową. Wylot naczynia zamknięto i energicznie wstrząśnięto uzyskując układ widoczny na zamieszczonej poniżej fotografii. Roztwór zawierał wówczas dwie różne sole.

Napisz w formie jonowej skróconej równanie reakcji chemicznej w wyniku której faza gazowa uległa odbarwieniu. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 22.3. Zapis równania reakcji chemicznej. Doświadczenia chemiczne w zadaniach część 1. Rozdział 1 (1 punkt)
W celu odróżnienia związków chemicznych – azotanu(III) sodu, jodku potasu oraz chlorku sodu, na ich próbki podziałano stężonym kwasem siarkowym(VI). Efekt przeprowadzonego doświadczenia ilustrują fotografie:

Napisz równanie reakcji chemicznej w wyniku której powstał produkt, w którym budujące go atomy pierwiastków miały taki sam stopień utlenienia jak przed dodaniem kwasu siarkowego(VI). © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 23. Zapis równania właściwego procesu chemicznego. Doświadczenia chemiczne w zadaniach część 1. Rozdział 1 (1 punkt)
Topniki lutownicze stanowią mieszaniny różnych substancji chemicznych, wśród których znajduje się chlorek cynku. Związek ten opisywany jest między innymi przedstawionym piktogramem ostrzegawczym.

Napisz w formie jonowej skróconej równanie procesu chemicznego, którego przebieg w wodnym roztworze chlorku cynku jest przyczyną oznaczenia tego związku chemicznego przedstawionym piktogramem. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 24. Zapis walencyjnej konfiguracji elektronowej atomu w stanie podstawowym. Doświadczenia chemiczne w zadaniach część 1. Rozdział 1 (1 punkt)
Do wodnego, bezbarwnego roztworu bromianu(V) potasu wprowadzono 10-procentowy roztwór kwasu solnego. Zamieszczona fotografia przedstawia naczynie reakcyjne chwilę po wymieszaniu wymienionych odczynników. Podczas przebiegu reakcji chemicznej wyczuwalny był charakterystyczny duszący zapach.

Stosując symbole podpowłok napisz konfigurację elektronów walencyjnych atomu pierwiastka w stanie podstawowym, którego cząsteczki stanowią wydzielający się gazowy produkt o duszącym zapachu. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 25.1. Zapis równania reakcji chemicznej odpowiedzialnej za powstanie barwy. Doświadczenia chemiczne w zadaniach część 1. Rozdział 1 (1 punkt)
Do wodnego, bezbarwnego roztworu bromianu(V) potasu wprowadzono 10-procentowy roztwór kwasu solnego. Zamieszczona fotografia przedstawia naczynie reakcyjne chwilę po wymieszaniu wymienionych odczynników. Podczas przebiegu reakcji chemicznej wyczuwalny był charakterystyczny duszący zapach.

Oprócz barwnego produktu gazowego, w trakcie przedstawionej przemiany chemicznej powstają również aniony proste. Drobiny te reagują z cząsteczkami opisanego gazu dając produkt, który fazie wodnej nadaje widoczne na fotografii zabarwienie.
Napisz w formie jonowej skróconej równanie reakcji chemicznej w wyniku której roztwór przyjmuje widoczne na fotografii zabarwienie. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 25.2. Zapis równania reakcji chemicznej odpowiedzialnej za powstanie brunatnej barwy. Doświadczenia chemiczne w zadaniach część 1. Rozdział 1 (1 punkt)
Do wodnego, bezbarwnego roztworu bromianu(V) potasu wprowadzono 10-procentowy roztwór kwasu solnego. Zamieszczona fotografia przedstawia naczynie reakcyjne chwilę po wymieszaniu wymienionych odczynników. Podczas przebiegu reakcji chemicznej wyczuwalny był charakterystyczny duszący zapach.

Oprócz barwnego produktu gazowego, w trakcie przedstawionej przemiany chemicznej powstają również aniony proste. Drobiny te reagują z cząsteczkami opisanego gazu dając produkt, który fazie wodnej nadaje widoczne na fotografii zabarwienie.
Po całkowitym usunięciu z mieszaniny poreakcyjnej opisanego gazu, pozostały roztwór wkraplano do probówki zawierającej wodny roztwór jednego ze związków chemicznych:
NaHSO4, BaSO4, KI, CaCl2.
Zamieszczona poniżej fotografia przedstawia zawartość naczynia w trakcie wykonywania opisanej czynności.

Napisz w formie jonowej skróconej równanie reakcji chemicznej, której przebieg był przyczyną pojawienia się widocznej na fotografii barwnej zmiany. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 26.1. Zapis równania procesu odpowiedzialnego za zmianę barwy papierka wskaźnikowego. Doświadczenia chemiczne w zadaniach część 1. Rozdział 1 (1 punkt)
W czterech kolbach, w losowej kolejności znajdowały się bezbarwne wodne roztwory: wodorowęglanu sodu, wodorotlenku sodu, wodorosiarczanu(VI) potasu i wodorotlenku baru. W każdej kolbie był roztwór innej substancji. Roztwory tych związków chemicznych oznaczono kolejnymi numerami 1.–4. W celu identyfikacji zawartości każdego naczynia przeprowadzono eksperyment.
Roztwór 1., który barwi uniwersalny papierek wskaźnikowy na kolor czerwony wprowadzono do trzech probówek, a następnie do każdej z nich dodano roztworu 2., 3. oraz 4. Analogicznie postąpiono z pozostałymi mieszaninami:
– do roztworu 2. dodano roztwory 1., 3. i 4.
– do roztworu 3. dodano roztwory 1., 2. i 4.
– do roztworu 4. dodano roztwory 1., 2. i 3.
Wyniki doświadczenia zebrano w tabeli.

Napisz stosując teorię kwasów i zasad Brønsteda-Lowry’ego równanie procesu chemicznego, którego przebieg powoduje opisaną zmianę barwy uniwersalnego papierka wskaźnikowego w roztworze 1. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 26.2. Zapis równań reakcji chemicznych. Doświadczenia chemiczne w zadaniach część 1. Rozdział 1 (2 punkty)
W czterech kolbach, w losowej kolejności znajdowały się bezbarwne wodne roztwory: wodorowęglanu sodu, wodorotlenku sodu, wodorosiarczanu(VI) potasu i wodorotlenku baru. W każdej kolbie był roztwór innej substancji. Roztwory tych związków chemicznych oznaczono kolejnymi numerami 1.–4. W celu identyfikacji zawartości każdego naczynia przeprowadzono eksperyment.
Roztwór 1., który barwi uniwersalny papierek wskaźnikowy na kolor czerwony wprowadzono do trzech probówek, a następnie do każdej z nich dodano roztworu 2., 3. oraz 4. Analogicznie postąpiono z pozostałymi mieszaninami:
– do roztworu 2. dodano roztwory 1., 3. i 4.
– do roztworu 3. dodano roztwory 1., 2. i 4.
– do roztworu 4. dodano roztwory 1., 2. i 3.
Wyniki doświadczenia zebrano w tabeli.

Napisz w formie jonowej skróconej równania reakcji chemicznych jakie przebiegły w probówkach 3. oraz 4. po wprowadzeniu do nich roztworu z 2. probówki. Probówka 3.: Probówka 4.: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
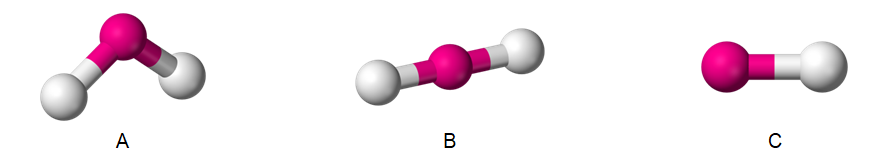
Zadanie 26.3. Wybór właściwego modelu przestrzennego. Doświadczenia chemiczne w zadaniach część 1. Rozdział 1 (1 punkt)
W czterech kolbach, w losowej kolejności znajdowały się bezbarwne wodne roztwory: wodorowęglanu sodu, wodorotlenku sodu, wodorosiarczanu(VI) potasu i wodorotlenku baru. W każdej kolbie był roztwór innej substancji. Roztwory tych związków chemicznych oznaczono kolejnymi numerami 1.–4. W celu identyfikacji zawartości każdego naczynia przeprowadzono eksperyment.
Roztwór 1., który barwi uniwersalny papierek wskaźnikowy na kolor czerwony wprowadzono do trzech probówek, a następnie do każdej z nich dodano roztworu 2., 3. oraz 4. Analogicznie postąpiono z pozostałymi mieszaninami:
– do roztworu 2. dodano roztwory 1., 3. i 4.
– do roztworu 3. dodano roztwory 1., 2. i 4.
– do roztworu 4. dodano roztwory 1., 2. i 3.
Wyniki doświadczenia zebrano w tabeli.

Spośród modeli A–C ilustrujących geometrię cząsteczek wybierz ten, który przedstawia cząsteczkę produktu opuszczającego 2. probówkę po dodaniu do jej zawartości roztworu z 1. probówki. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone