Wskazanie barwy kwiatów rośliny wraz z uzasadnieniem. Zadanie 9ab. Arkusz CKE chemia maj 2010 rozszerzony (2 punkty)
Pewna roślina rosnąca na glebie o odczynie kwasowym ma kwiaty w kolorze niebieskim, a gdy odczyn gleby jest zasadowy, jej kwiaty mają zabarwienie różowoczerwone. Gleba, na której posadzono tę roślinę, pierwotnie miała odczyn obojętny, ale do jej użyźnienia
zastosowano siarczan(VI) amonu.
a) Określ kolor, na jaki zabarwiły się kwiaty tej rośliny po użyciu siarczanu(VI) amonu. Kwiaty zabarwiły się na kolor: b) Uzasadnij swoją odpowiedź, zapisując w formie jonowej skróconej odpowiednie równanie reakcji. Równanie reakcji:
Wskazanie sprzężonych par kwas-zasada Brønsteda. Zadanie 10. Arkusz CKE chemia maj 2010 rozszerzony (2 punkty)
W teorii Brønsteda sprzężoną parą kwas-zasada nazywa się układ złożony z kwasu oraz zasady, która powstaje z tego kwasu przez odłączenie protonu.
Dla przemiany przedstawionej równaniem: CH3NH2 + H2O ⇄ CH3NH3+ + OH– napisz wzory kwasów i zasad, które w tej reakcji tworzą sprzężone pary.
Uszeregowanie kwasów karboksylowych według rosnącej mocy. Zadanie 11. Arkusz CKE chemia maj 2010 rozszerzony (1 punkt)
W poniższej tabeli podano wartości stopnia dysocjacji trzech kwasów karboksylowych w ich wodnych roztworach o stężeniu 0,1 mol/dm3 w temperaturze 25 oC.
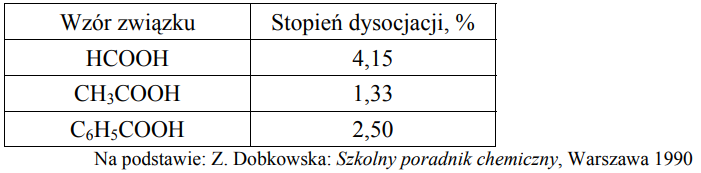
Na podstawie podanych wartości stopnia dysocjacji uszereguj podane kwasy od najsłabszego do najmocniejszego.
Zapis równań reakcji chemicznych kwasów z solami. Zadanie 12a. Arkusz CKE chemia maj 2010 rozszerzony (1 punkt)
Przygotowano wodne roztwory kwasów HX i HY oraz ich soli NaX i NaY, wszystkie o stężeniach 1 mol/dm3 . Stałe dysocjacji kwasowej HX i HY w temperaturze 25 oC są odpowiednio równe: Ka(HX) = 4,0·10-5, Ka(HY) = 2,3·10-2.
Posługując się zapisem w formie cząsteczkowej, dopisz do podanych substratów produkty reakcji lub napisz, że przemiana nie zachodzi. NaX + HY → NaY + HX →
Wskazanie kwasu, którego wodny roztwór ma wyższe pH. Zadanie 12b. Arkusz CKE chemia maj 2010 rozszerzony (1 punkt)
Przygotowano wodne roztwory kwasów HX i HY oraz ich soli NaX i NaY, wszystkie o stężeniach 1 mol/dm3 . Stałe dysocjacji kwasowej HX i HY w temperaturze 25 oC są odpowiednio równe: Ka(HX) = 4,0·10-5, Ka(HY) = 2,3·10-2.
Wskaż kwas (HX lub HY), którego roztwór o stężeniu 1 mol/dm3 ma wyższe pH.
Wyjaśnienie, dlaczego stała dysocjacji lepiej charakteryzuje moc elektrolitu. Zadanie 13. Arkusz CKE chemia maj 2010 rozszerzony (1 punkt)
Do oceny mocy elektrolitu stosuje się stopień dysocjacji oraz stałą dysocjacji, jednak w tablicach chemicznych zwykle podawane są wartości stałej dysocjacji.
Wyjaśnij, dlaczego stała dysocjacji lepiej charakteryzuje moc elektrolitu.
Obliczanie stężenia równowagowego pary wodnej. Zadanie 14. Arkusz CKE chemia maj 2010 rozszerzony (2 punkty)
W temperaturze 700 K stężeniowa stała równowagi reakcji opisanej równaniem:
CO (g)+ H2O (g) ⇄ CO2 (g)+ H2 (g)
ma wartość 9,0. Do reakcji tej użyto pary wodnej (H2O) oraz gazu syntezowego, czyli mieszaniny CO i H2, zamiast czystego CO. Reakcję prowadzono w układzie zamkniętym. Po osiągnięciu stanu równowagi w temperaturze 700 K stężenia CO, CO2, H2 były odpowiednio równe: [CO] = 0,3 mol/dm3 , [CO2] = 6,3 mol/dm3 , [H2] = 12,9 mol/dm3.
Oblicz stężenie równowagowe pary wodnej w temperaturze 700 K. Wynik podaj z dokładnością do jednego miejsca po przecinku.
Obliczanie stosunku molowego tlenku węgla(II) oraz wodoru użytych do reakcji. Zadanie 15. Arkusz CKE chemia maj 2010 rozszerzony (2 punkty)
W temperaturze 700 K stężeniowa stała równowagi reakcji opisanej równaniem:
CO (g)+ H2O (g) ⇄ CO2 (g)+ H2 (g)
ma wartość 9,0. Do reakcji tej użyto pary wodnej (H2O) oraz gazu syntezowego, czyli mieszaniny CO i H2, zamiast czystego CO. Reakcję prowadzono w układzie zamkniętym. Po osiągnięciu stanu równowagi w temperaturze 700 K stężenia CO, CO2, H2 były odpowiednio równe: [CO] = 0,3 mol/dm3 , [CO2] = 6,3 mol/dm3 , [H2] = 12,9 mol/dm3.
Korzystając z podanych w informacji wartości stężeń równowagowych reagentów, oblicz i napisz, w jakim stosunku molowym występowały CO i H2 w gazie syntezowym użytym do realizacji opisanej przemiany.
Zapis równania reakcji chemicznej oraz wskazanie charakteru chemicznego jej produktu. Zadanie 16ab. Arkusz CKE chemia maj 2010 rozszerzony (2 punkty)
Do dwóch probówek wprowadzono po 5 cm3 wodnego roztworu chlorku chromu(III). Do każdej z nich dodano po 5 cm3 rozcieńczonej wody amoniakalnej i zaobserwowano wytrącenie się osadu o barwie szarozielonej. Następnie do pierwszej probówki dodano kilka cm3 stężonego roztworu wodorotlenku sodu, a do drugiej taką samą objętość kwasu solnego. Zaobserwowano, że szarozielony osad rozpuścił się w obu probówkach.
a) Napisz w formie cząsteczkowej równanie reakcji chlorku chromu(III) z wodą amoniakalną. b) Na podstawie opisanych wyników doświadczenia określ charakter chemiczny związku tworzącego osad o szarozielonej barwie.
Bilans jonowo-elektronowy oraz wskazanie stosunku molowego utleniacza do reduktora. Zadanie 17abc. Arkusz CKE chemia maj 2010 rozszerzony (4 punkty)
Aniony dichromianowe(VI) reagują z kationami żelaza(II) w środowisku kwasowym według następującego schematu:
Cr2O72– + Fe2+ + H+ → Cr3+ + Fe3+ + H2O
a) Napisz w formie jonowej z uwzględnieniem oddawanych lub pobieranych elektronów (zapis jonowo-elektronowy) równania procesów redukcji i utleniania dokonujących się w czasie tej reakcji. Równanie procesu redukcji: Równanie procesu utleniania: b) Dobierz i uzupełnij współczynniki stechiometryczne w poniższym schemacie. c) Podaj stosunek molowy utleniacza do reduktora. Stosunek molowy utleniacza do reduktora:![]()
Zapis równania reakcji chemicznej biegnącej w pracującym ogniwie niklowo-kadmowym. Zadanie 18a. Arkusz CKE chemia maj 2010 rozszerzony (1 punkt)
W poniższej tabeli przedstawiono równania reakcji elektrodowych oraz odpowiadające im wartości potencjałów standardowych dwóch półogniw redoks tworzących tzw. ogniwo niklowo-kadmowe.
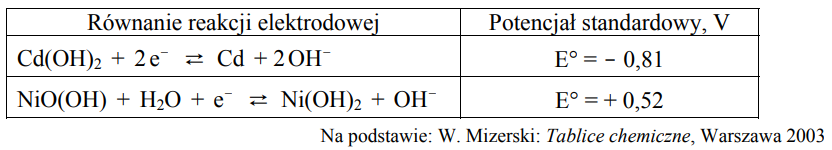
Korzystając z podanych informacji, napisz sumaryczne równanie reakcji, która zachodzi w pracującym ogniwie niklowo-kadmowym.
Obliczanie SEM ogniwa niklowo-kadmowego. Zadanie 18b. Arkusz CKE chemia maj 2010 rozszerzony (1 punkt)
W poniższej tabeli przedstawiono równania reakcji elektrodowych oraz odpowiadające im wartości potencjałów standardowych dwóch półogniw redoks tworzących tzw. ogniwo niklowo-kadmowe.

Oblicz siłę elektromotoryczną (SEM) tego ogniwa w warunkach standardowych. SEM:
Wybór właściwego metalu jako protektora antykorozyjnego. Zadanie 19. Arkusz CKE chemia maj 2010 rozszerzony (1 punkt)
Wilgotne powietrze stanowi środowisko korozyjne, w którym metalowe przedmioty narażone są na zniszczenie. Metale można chronić przed korozją przez powlekanie ich powierzchni innymi metalami. Jeżeli w tym celu zastosuje się metal o potencjale większym od potencjału metalu chronionego (powłoka katodowa), pełne zabezpieczenie uzyskuje się tylko wówczas, gdy powłoka jest całkowicie szczelna. Jeżeli natomiast zastosuje się powłokę wykonaną z metalu o potencjale mniejszym od potencjału metalu chronionego (powłoka anodowa), jej uszkodzenie nie powoduje korozji metalu podłoża. O charakterze danej powłoki metalicznej na stali można wnioskować, porównując wartości standardowych potencjałów odpowiednich elektrod (typu Me/Men+).
Oceń, który metal (cynk czy miedź) powinien być zastosowany do ochrony przed korozją w wilgotnym powietrzu stalowego przedmiotu narażonego na zarysowania. Wybrany metal:
Rysowanie wzoru grupowego węglowodoru o o kreślonej strukturze cząsteczki. Zadanie 21. Arkusz CKE chemia maj 2010 rozszerzony (1 punkt)
Narysuj wzór strukturalny lub półstrukturalny (grupowy) węglowodoru, w którego cząsteczce występuje osiem wiązań σ i jedno wiązanie π.

