Projektowanie doświadczenia, które pozwoli na rozróżnienie wodnych roztworów glukozy i fruktozy. Zadanie 31ab. Arkusz CKE chemia maj 2011 rozszerzony (2 punkty)
Zaprojektuj doświadczenie, które pozwoli na rozróżnienie wodnych roztworów dwóch cukrów: glukozy i fruktozy.
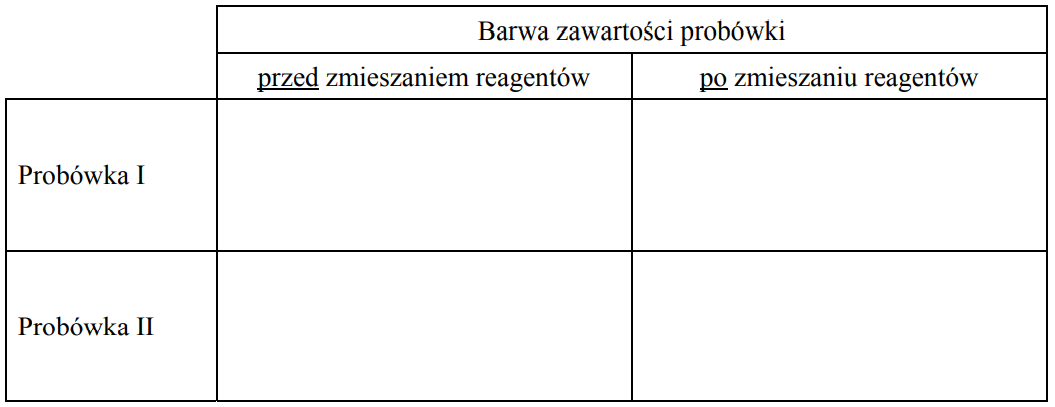
a) Uzupełnij schemat doświadczenia, wpisując nazwę użytego odczynnika wybranego z podanej poniżej listy: – świeżo wytrącony wodorotlenek miedzi(II) b) Napisz, jakie obserwacje potwierdzą obecność glukozy w probówce I i fruktozy w probówce II po wprowadzeniu tych substancji do wybranego odczynnika (wypełnij poniższą tabelę).
- woda bromowa z dodatkiem wodnego roztworu wodorowęglanu sodu
- wodny roztwór azotanu(V) srebra z dodatkiem wodnego roztworu amoniaku.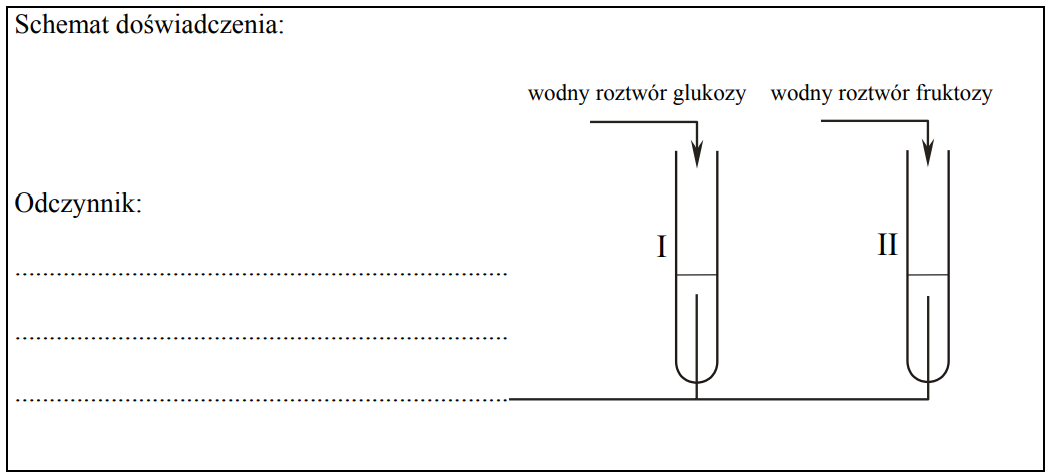
Określanie charakteru chemicznego substancji na podstawie przeprowadzonego doświadczenia. Zadanie 32. Arkusz CKE chemia maj 2011 rozszerzony (1 punkt)
Przeprowadzono doświadczenie zilustrowane poniższym rysunkiem.
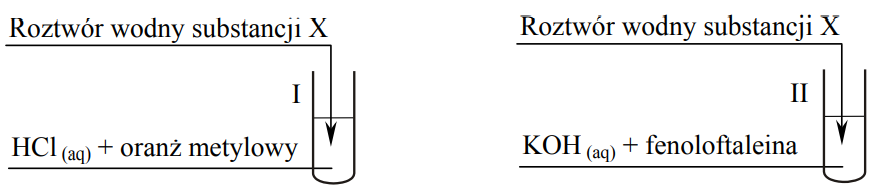
W obu probówkach nastąpiła zmiana barwy wskaźników.
Korzystając z przeprowadzonego doświadczenia, określ charakter chemiczny substancji X.
Wybór właściwego związku chemicznego oraz zapis równań jego reakcji z roztworem kwasu i zasady. Zadanie 33ab. Arkusz CKE chemia maj 2011 rozszerzony (3 punkty)
Przeprowadzono doświadczenie zilustrowane poniższym rysunkiem.
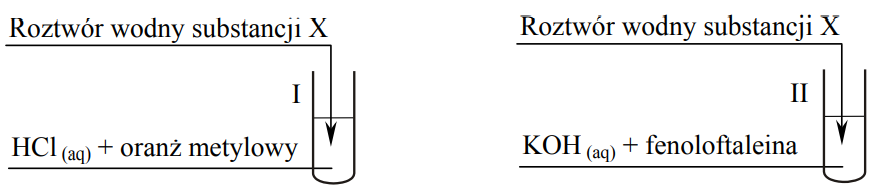
W obu probówkach nastąpiła zmiana barwy wskaźników.
a) Spośród wymienionych związków: benzen, etanol, propanal, kwas aminoetanowy (glicyna) wybierz ten, którego użyto w doświadczeniu jako substancję X, i napisz jego nazwę. b) Napisz w formie jonowej skróconej równania reakcji przebiegających w probówkach I i II. Zastosuj wzory półstrukturalne (grupowe). Probówka I: Probówka II:
Wybór właściwego aminokwasu użytego podczas przeprowadzonego doświadczenia. Zadanie 34. Arkusz CKE chemia maj 2011 rozszerzony (1 punkt)
Pewne reakcje chemiczne, którym ulegają niektóre aminokwasy wchodzące w skład białek, stosuje się jako próby rozpoznawcze na obecność białka. Jedną z takich prób jest reakcja ksantoproteinowa. Przeprowadzono doświadczenie, w którym do znajdującego się w probówce białka jaja kurzego dodano stężony kwas azotowy(V) i zaobserwowano pojawienie się osadu o żółtej barwie.
Spośród podanych poniżej wzorów aminokwasów podkreśl wzór tego, którego obecność w białku spowodowała powstanie żółtego osadu.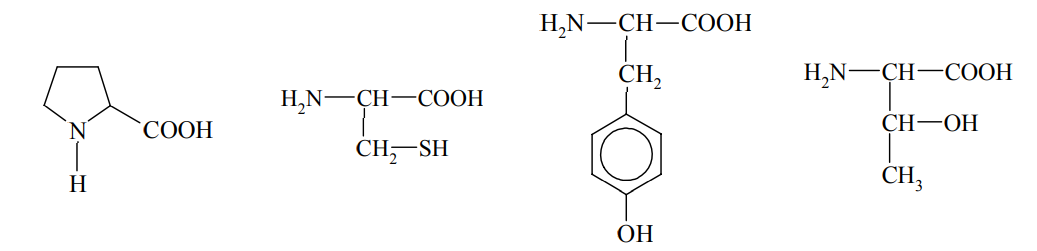
Wybór poprawnych określeń w celu uzyskania prawdziwych zdań dotyczących białek. Zadanie 35. Arkusz CKE chemia maj 2011 rozszerzony (2 punkty)
Uzupełnij poniższe zdania dotyczące właściwości białek, wpisując w odpowiedniej formie gramatycznej określenia wybrane z poniższego zestawu.
denaturacja, wysolenie, roztwór właściwy, roztwór koloidalny, zawiesina, polarne, niepolarne, hydratacja, dysocjacja, odwracalny, nieodwracalny
1. Białko jaja kurzego rozpuszcza się w wodzie, tworząc . Każda cząsteczka białka w roztworze posiada tzw. otoczkę solwatacyjną. Solwatacja cząsteczek białka jest możliwa ze względu na obecność grup hydroksylowych, karboksylowych i aminowych w łańcuchach bocznych aminokwasów. 2. Otoczkę solwatacyjną białek można zniszczyć przez dodanie do roztworu soli, np. NaCl, której jony są silniej solwatowane. Widoczne jest wtedy wytrącenie białka z roztworu, zwane . Proces ten jest . Pod wpływem wysokiej temperatury, soli metali ciężkich czy też stężonych kwasów lub zasad białka wytrącają się z roztworów w sposób . Zjawisko to nosi nazwę .
Rozszyfrowanie symbolu pierwiastka chemicznego na podstawie konfiguracji elektronowej jego kationu. Zadanie 1. Arkusz CKE chemia maj 2010 rozszerzony (1 punkt)
Atomy pierwiastka X tworzą jony X3+, których konfigurację elektronową można zapisać: 1s2 2s2 2p6 3s2 3p6 3d10
Uzupełnij poniższą tabelę, wpisując symbol pierwiastka X, dane dotyczące jego położenia w układzie okresowym oraz symbol bloku konfiguracyjnego (energetycznego) s, p lub d, do którego należy pierwiastek X.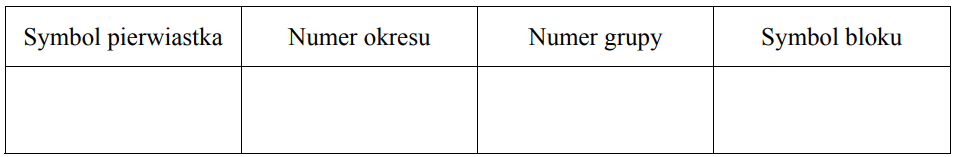
Zapis równań dwóch przemian promieniotwórczych. Zadanie 2. Arkusz CKE chemia maj 2010 rozszerzony (2 punkty)
Jednym z pierwszych sztucznie otrzymanych radionuklidów był izotop azotu 13N. Powstał on w wyniku napromieniowania izotopu boru 10B cząstkami α pochodzącymi z naturalnej przemiany promieniotwórczej, jakiej ulega izotop polonu 210Po.
Napisz równania przemian promieniotwórczych opisanych powyżej. Równanie przemiany, jakiej ulega izotop polonu 210Po: Równanie przemiany, w której powstaje izotop azotu 13N:
Wskazanie związków chemicznych o budowie jonowej. Zadanie 3. Arkusz CKE chemia maj 2010 rozszerzony (1 punkt)
Poniżej podano wzory pięciu związków chemicznych.
Podkreśl te wzory, które przedstawiają związki chemiczne występujące w postaci kryształów jonowych (tak jak chlorek sodu), a nie zbiorów cząsteczek. CCl4 Li2O SO2 CS2 BaBr2
Zapis równania otrzymywania tlenku wskazaną metodą. Zadanie 4. Arkusz CKE chemia maj 2010 rozszerzony (1 punkt)
Chlor tworzy tlenki, w których przyjmuje różne stopnie utlenienia. Tlenek, w którym chlor występuje na najwyższym stopniu utlenienia, otrzymuje się w reakcji odwodnienia (dehydratacji) kwasu chlorowego zawierającego chlor na tym samym stopniu utlenienia.
Napisz równanie reakcji otrzymywania tego tlenku powyższą metodą.
Wskazanie wartości ciśnienia. Zadanie 5a. Arkusz CKE chemia maj 2010 rozszerzony (1 punkt)
W dwóch jednakowych zbiornikach o objętości 2,0 dm3 każdy umieszczono oddzielnie takie same liczby moli substancji gazowych X i Y. Masa molowa substancji X jest dwa razy większa od masy molowej substancji Y. Temperatura w obu zbiornikach jest równa 481,3 K, a ciśnienie w zbiorniku z substancją X jest równe 2000,0 hPa.
Podaj wartość ciśnienia panującego w zbiorniku z substancją Y.
Obliczanie wartości ciśnienia po zmianie temperatury. Zadanie 5b. Arkusz CKE chemia maj 2010 rozszerzony (2 punkty)
W dwóch jednakowych zbiornikach o objętości 2,0 dm3 każdy umieszczono oddzielnie takie same liczby moli substancji gazowych X i Y. Masa molowa substancji X jest dwa razy większa od masy molowej substancji Y. Temperatura w obu zbiornikach jest równa 481,3 K, a ciśnienie w zbiorniku z substancją X jest równe 2000,0 hPa.
Oblicz, jaką wartość osiągnie ciśnienie w zbiorniku z substancją X, jeśli temperatura wzrośnie w nim o 100,0 K. Stała gazowa R = 83,1 dm3·hPa·mol–1·K–1. Wynik podaj z dokładnością do jednego miejsca po przecinku.
Wskazanie gazu o większej gęstości. Zadanie 6. Arkusz CKE chemia maj 2010 rozszerzony (1 punkt)
W dwóch jednakowych zbiornikach o objętości 2,0 dm3 każdy umieszczono oddzielnie takie same liczby moli substancji gazowych X i Y. Masa molowa substancji X jest dwa razy większa od masy molowej substancji Y. Temperatura w obu zbiornikach jest równa 481,3 K, a ciśnienie w zbiorniku z substancją X jest równe 2000,0 hPa.
Wskaż gaz (X lub Y), który ma większą gęstość w warunkach normalnych.
Rysowanie wykresu zależności rozpuszczalności KCl w wodzie od temperatury. Zadanie 7. Arkusz CKE chemia maj 2010 rozszerzony (2 punkty)
Stężenie procentowe nasyconego wodnego roztworu chlorku potasu o temperaturze 20 oC wynosi 25,37% masowych. Rozpuszczalność w wodzie tego związku w temperaturze 40 oC jest równa 40 g/100 g wody. W przedziale od 0 oC do 50 oC zależność rozpuszczalności chlorku potasu od temperatury jest liniowa.
Korzystając z powyższych informacji, uzupełnij tabelę, a następnie narysuj wykres zależności rozpuszczalności chlorku potasu w wodzie od temperatury w przedziale od 0 oC do 50 oC. 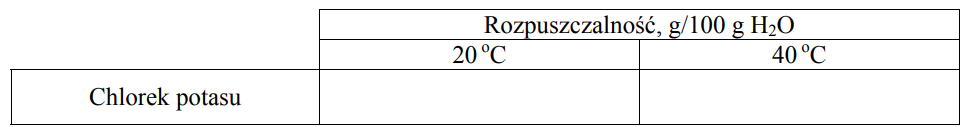
Obliczanie stężenia procentowego roztworu kwasu solnego. Zadanie 8. Arkusz CKE chemia maj 2010 rozszerzony (2 punkty)
W 1,00 dm3 wody rozpuszczono 112,00 dm3 chlorowodoru odmierzonego w warunkach normalnych.
Oblicz stężenie procentowe otrzymanego kwasu solnego w procentach masowych. Załóż, że gęstość wody wynosi 1,00 g·cm–3. Wynik podaj z dokładnością do dwóch miejsc po przecinku.

