Zapis równania reakcji prowadzącej do powstania kwasu pirośluzowego. Zadanie 32.2. Arkusz CKE chemia maj 2015 rozszerzony (1 punkt)
Furfural jest pochodną furanu. W cząsteczce furfuralu występuje grupa funkcyjna, która łatwo redukuje się w obecności wodoru, co prowadzi do powstania alkoholu furfurylowego. Na gorąco, pod wpływem wodorotlenku miedzi(II), grupa ta się utlenia, w wyniku czego powstaje kwas pirośluzowy.
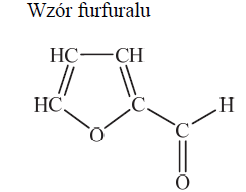
Na podstawie: K.-H. Lautenschläger, W. Schröter, A. Wanninger, Nowoczesne kompendium chemii, Warszawa 2007.
Uzupełnij poniższy schemat, tak aby otrzymać równanie opisanej reakcji otrzymywania kwasu pirośluzowego. Zastosuj wzory półstrukturalne (grupowe) lub uproszczone związków organicznych.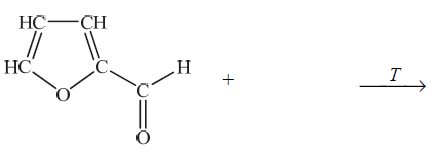
Wybór poprawnych odczynników w celu porównania mocy kwasów pirogronowego i octowego. Zadanie 33.1. Arkusz CKE chemia maj 2015 rozszerzony (1 punkt)
Moc kwasów można porównać na podstawie analizy ich stałych dysocjacji albo metodą doświadczalną. Stała dysocjacji kwasu pirogronowego jest równa Ka = 4,1·10−3 w t = 25 °C.
Na podstawie: J. Sawicka i inni, Tablice chemiczne, Gdańsk 2004.
Porównaj wartości stałych dysocjacji kwasu pirogronowego i kwasu etanowego, a następnie zaprojektuj doświadczenie, w którym zajdzie reakcja potwierdzająca, że jeden z nich jest mocniejszy.
Uzupełnij poniższy schemat doświadczenia, wpisując wzory użytych odczynników wybranych spośród: Schemat doświadczenia:
– CH3COCOOH (aq)
– CH3COCOONa (aq)
– CH3COOH (aq)
– CH3COONa (aq)
– NaOH (aq)
Opis zmian towarzyszących przeprowadzonemu doświadczeniu porównania mocy kwasów pirogronowego i octowego. Zadanie 33.2. Arkusz CKE chemia maj 2015 rozszerzony (1 punkt)
Moc kwasów można porównać na podstawie analizy ich stałych dysocjacji albo metodą doświadczalną. Stała dysocjacji kwasu pirogronowego jest równa Ka = 4,1·10−3 w t = 25 °C.
Na podstawie: J. Sawicka i inni, Tablice chemiczne, Gdańsk 2004.
Porównaj wartości stałych dysocjacji kwasu pirogronowego i kwasu etanowego, a następnie zaprojektuj doświadczenie, w którym zajdzie reakcja potwierdzająca, że jeden z nich jest mocniejszy.
Opisz zmiany, które potwierdzają, że wybrany kwas jest mocniejszy od drugiego.
Wybór odczynnika pozwalającego odróżnić parafinę od stearyny. Zadanie 34. Arkusz CKE chemia maj 2015 rozszerzony (1 punkt)
W dwóch nieoznakowanych probówkach znajdują się parafina i stearyna.
Zaznacz poprawne dokończenie zdania. W celu zidentyfikowania tych substancji należy A. porównać ich rozpuszczalność w wodzie. B. zbadać ich zachowanie wobec wody bromowej. C. zbadać ich zachowanie wobec wodorotlenku sodu. D. zbadać ich zachowanie wobec stężonego kwasu azotowego(V).
Rysowanie wzoru Hawortha α-D-mannopiranozy na podstawie jej projekcji Fischera. Zadanie 35. Arkusz CKE chemia maj 2015 rozszerzony (1 punkt)
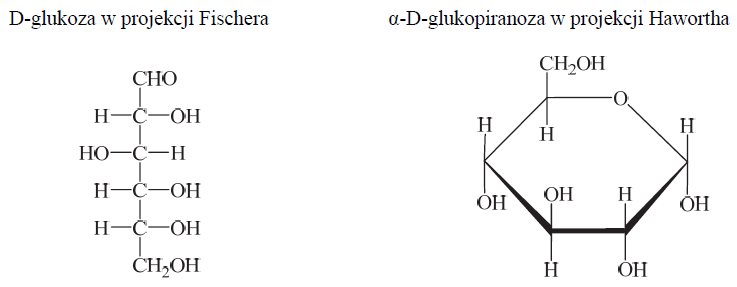
Wzory monosacharydów można przedstawiać, posługując się projekcją Fischera (wzory liniowe) lub projekcją Hawortha (wzory taflowe). Poniżej przedstawiono wzór D-glukozy w projekcji Fischera oraz wzór α-D-glukopiranozy w projekcji Hawortha.
Przeanalizuj wzór D-mannozy w projekcji Fischera i uzupełnij schemat, tak aby przedstawiał on wzór α-D-mannopiranozy w projekcji Hawortha.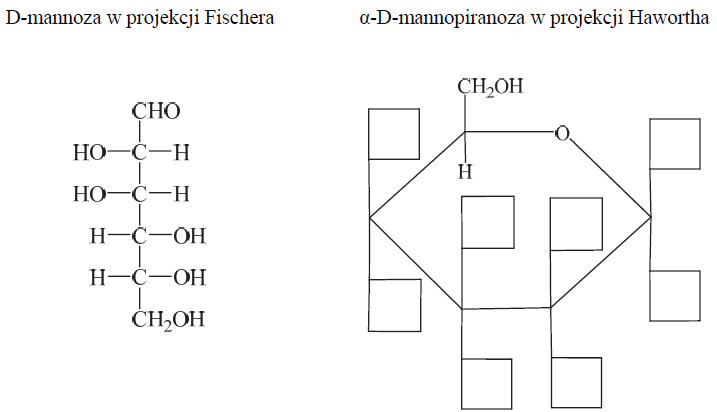
Uszeregowanie tłuszczy zgodnie ze wzrastającą liczbą jodową. Zadanie 36. Arkusz CKE chemia maj 2015 rozszerzony (1 punkt)
Liczba jodowa jest miarą liczby wiązań nienasyconych, np. w tłuszczach. Określa ona liczbę gramów jodu, który może przyłączyć w warunkach standardowych 100 gramów tłuszczu.
Na podstawie: Encyklopedia szkolna. Chemia, Kraków 2005.
Poniżej podano wzory trzech tłuszczów.
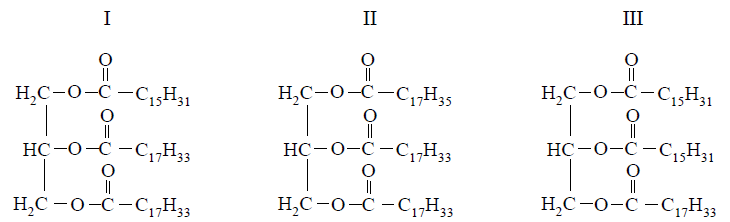
Uszereguj tłuszcze o podanych wzorach zgodnie ze wzrastającą liczbą jodową − zapisz w kolejności numery, którymi je oznaczono.
Zapis nazw zidentyfikowanych związków chemicznych. Zadanie 37. Arkusz CKE chemia maj 2015 rozszerzony (1 punkt)
W czterech naczyniach (I–IV) znajdowały się wodne roztwory: glukozy, fenolu (benzenolu), glicerolu (propano-1,2,3-triolu) i glicyloalanyloglicyny. W celu ich identyfikacji przeprowadzono trzy serie doświadczeń. W pierwszej serii doświadczeń, po dodaniu wodnego roztworu chlorku żelaza(III) do próbek pobranych z czterech naczyń, próbka z naczynia I przyjęła fioletowe zabarwienie. W drugiej serii doświadczeń, po dodaniu świeżo strąconego wodorotlenku miedzi(II) do próbek pobranych z trzech naczyń (II, III i IV), próbka z naczynia II przyjęła fioletowe zabarwienie, a w pozostałych próbkach pojawiło się szafirowe zabarwienie. W trzeciej serii doświadczeń, po ogrzaniu szafirowych roztworów otrzymanych w serii drugiej, w roztworze powstałym z próbki z naczynia III pojawił się ceglasty osad.
Podaj nazwy związków, które zidentyfikowano w wyniku każdej z serii doświadczeń. Seria I (naczynie I): roztwór Seria II (naczynie II): roztwór Seria III (naczynie III): roztwór (naczynie IV): roztwór
Zapis nazwy reakcji chemicznej, której przebieg doprowadził do powstania fioletowego zabarwienia. Zadanie 38. Arkusz CKE chemia maj 2015 rozszerzony (1 punkt)
W czterech naczyniach (I–IV) znajdowały się wodne roztwory: glukozy, fenolu (benzenolu), glicerolu (propano-1,2,3-triolu) i glicyloalanyloglicyny. W celu ich identyfikacji przeprowadzono trzy serie doświadczeń. W pierwszej serii doświadczeń, po dodaniu wodnego roztworu chlorku żelaza(III) do próbek pobranych z czterech naczyń, próbka z naczynia I przyjęła fioletowe zabarwienie. W drugiej serii doświadczeń, po dodaniu świeżo strąconego wodorotlenku miedzi(II) do próbek pobranych z trzech naczyń (II, III i IV), próbka z naczynia II przyjęła fioletowe zabarwienie, a w pozostałych próbkach pojawiło się szafirowe zabarwienie. W trzeciej serii doświadczeń, po ogrzaniu szafirowych roztworów otrzymanych w serii drugiej, w roztworze powstałym z próbki z naczynia III pojawił się ceglasty osad.
Podaj nazwę reakcji chemicznej przeprowadzonej w drugiej serii doświadczeń, w wyniku której roztwór z naczynia II przyjął fioletowe zabarwienie.
Wskazanie elementu budowy cząsteczki którego obecność pozwala uzyskać szafirowy roztwór. Zadanie 39. Arkusz CKE chemia maj 2015 rozszerzony (1 punkt)
W czterech naczyniach (I–IV) znajdowały się wodne roztwory: glukozy, fenolu (benzenolu), glicerolu (propano-1,2,3-triolu) i glicyloalanyloglicyny. W celu ich identyfikacji przeprowadzono trzy serie doświadczeń. W pierwszej serii doświadczeń, po dodaniu wodnego roztworu chlorku żelaza(III) do próbek pobranych z czterech naczyń, próbka z naczynia I przyjęła fioletowe zabarwienie. W drugiej serii doświadczeń, po dodaniu świeżo strąconego wodorotlenku miedzi(II) do próbek pobranych z trzech naczyń (II, III i IV), próbka z naczynia II przyjęła fioletowe zabarwienie, a w pozostałych próbkach pojawiło się szafirowe zabarwienie. W trzeciej serii doświadczeń, po ogrzaniu szafirowych roztworów otrzymanych w serii drugiej, w roztworze powstałym z próbki z naczynia III pojawił się ceglasty osad.
Napisz, jaki element budowy cząsteczek związków znajdujących się w roztworach z naczyń III i IV zadecydował o powstaniu szafirowego zabarwienia roztworów w drugiej serii doświadczeń.
Wyjaśnienie, dlaczego w jednym z naczyń powstał ceglasty osad a w drugim nie. Zadanie 40. Arkusz CKE chemia maj 2015 rozszerzony (1 punkt)
W czterech naczyniach (I–IV) znajdowały się wodne roztwory: glukozy, fenolu (benzenolu), glicerolu (propano-1,2,3-triolu) i glicyloalanyloglicyny. W celu ich identyfikacji przeprowadzono trzy serie doświadczeń. W pierwszej serii doświadczeń, po dodaniu wodnego roztworu chlorku żelaza(III) do próbek pobranych z czterech naczyń, próbka z naczynia I przyjęła fioletowe zabarwienie. W drugiej serii doświadczeń, po dodaniu świeżo strąconego wodorotlenku miedzi(II) do próbek pobranych z trzech naczyń (II, III i IV), próbka z naczynia II przyjęła fioletowe zabarwienie, a w pozostałych próbkach pojawiło się szafirowe zabarwienie. W trzeciej serii doświadczeń, po ogrzaniu szafirowych roztworów otrzymanych w serii drugiej, w roztworze powstałym z próbki z naczynia III pojawił się ceglasty osad.
Wyjaśnij, dlaczego w trzeciej serii doświadczeń ceglasty osad powstał w wyniku ogrzania roztworu otrzymanego po dodaniu świeżo strąconego wodorotlenku miedzi(II) do roztworu z naczynia III, a nie powstał w wyniku ogrzania roztworu otrzymanego po dodaniu świeżo strąconego wodorotlenku miedzi(II) do roztworu z naczynia IV.
Zapis sekwencji aminokwasów tripeptydu na podstawie produktów jego hydrolizy. Zadanie 41. Arkusz CKE chemia maj 2015 rozszerzony (1 punkt)
Pewien tripeptyd tworzą tylko reszty glicyny (Gly) i alaniny (Ala). W doświadczeniu I tripeptyd ten poddano częściowej hydrolizie polegającej na rozerwaniu wyłącznie N-końcowego wiązania peptydowego. Otrzymano mieszaninę dwóch optycznie czynnych produktów. W doświadczeniu II przeprowadzono hydrolizę badanego tripeptydu, tak że rozerwaniu uległo wyłącznie C-końcowe wiązanie peptydowe. W jej wyniku otrzymano mieszaninę produktów, spośród których tylko jeden był optycznie czynny.
Napisz wzór sekwencji badanego tripeptydu, posługując się trzyliterowymi symbolami aminokwasów. Pamiętaj, że w tej notacji z lewej strony umieszcza się symbol aminokwasu, który zawiera wolną grupę aminową.
Wskazanie wielkości, których wzrost wskazują strzałki. Zadanie 1. Arkusz CKE chemia maj 2014 rozszerzony (2 punkty)
Na rysunku przedstawiono schemat układu okresowego pierwiastków (bez lantanowców i aktynowców), na którym umieszczono strzałki A i B odpowiadające kierunkom zmian
wybranych wielkości charakteryzujących pierwiastki chemiczne.
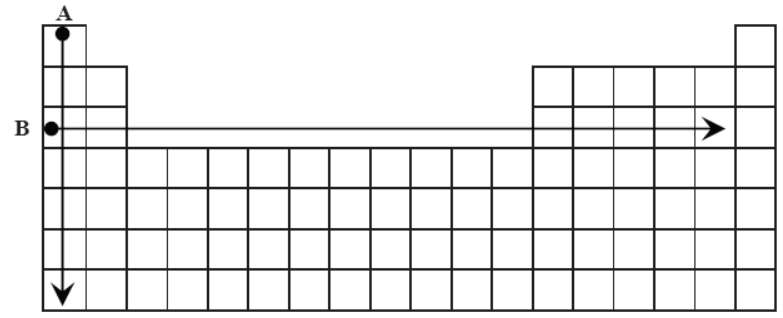
Podkreśl wszystkie wymienione poniżej wielkości, których wzrost wskazują strzałki oznaczone literami A i B. 1. Dla pierwiastków 1. grupy strzałka A wskazuje kierunek wzrostu najwyższego stopnia utlenienia promienia atomowego promienia jonowego. 2. Dla pierwiastków grup 1.–2. i 13.–17. okresu III strzałka B wskazuje kierunek wzrostu najwyższego stopnia utlenienia promienia atomowego charakteru metalicznego.
Ocena poprawności zdań dotyczących trzech pierwiastków chemicznych. Zadanie 2. Arkusz CKE chemia maj 2014 rozszerzony (1 punkt)
Na poniższym schemacie układu okresowego pierwiastków (bez lantanowców i aktynowców) zaznaczono położenie trzech pierwiastków oznaczonych numerami I, II oraz III.
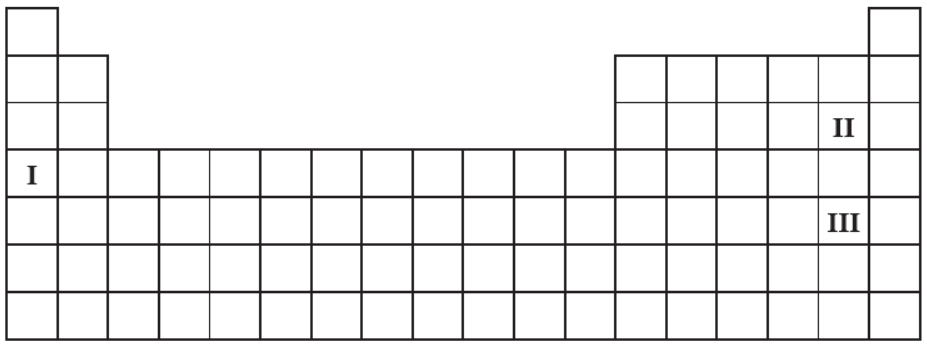
Wypełnij tabelę, wpisując literę P, jeżeli informacja jest prawdziwa, lub literę F, jeżeli jest fałszywa. 1. Pierwiastek I jest aktywnym metalem. Tworzy wodorek, w którym wodór przyjmuje stopień utlenienia równy – I. 2. Atomy pierwiastka II mają silniejszą tendencję do przyłączania elektronu niż atomy pierwiastka III. W konsekwencji pierwiastek II jest silniejszym utleniaczem niż pierwiastek III. 3. Wodorki pierwiastków II oraz III, rozpuszczając się w wodzie, ulegają dysocjacji jonowej. Stała dysocjacji wodorku pierwiastka II jest większa od stałej dysocjacji wodorku pierwiastka III.
Wskazanie nazwy wielkości fizycznej. Zadanie 3a. Arkusz CKE chemia maj 2014 rozszerzony (1 punkt)
Na poniższym wykresie przedstawiono zależność pewnej makroskopowej wielkości charakteryzującej pierwiastki chemiczne w funkcji ich liczby atomowej Z.
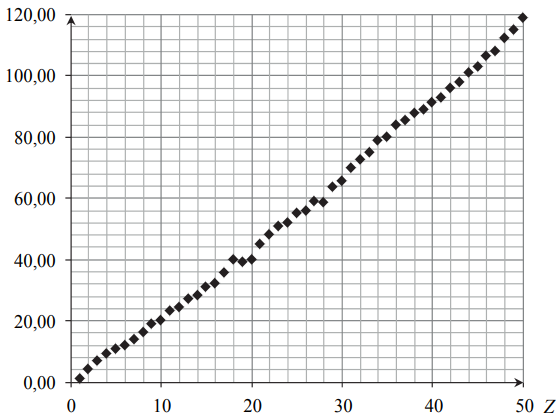
Opisz oś pionową wykresu, podając nazwę tej wielkości oraz jednostkę, w jakiej jest ona wyrażana.
Opis osi pionowej:

