Ocena poprawności zdań dotyczących ciągu przemian kwasu askorbinowego w kwas dehydroaskorbinowy. Zadanie 36. Arkusz CKE chemia maj 2016 rozszerzony (1 punkt)
Kwas askorbinowy ulega przemianie w kwas dehydroaskorbinowy zgodnie z poniższym schematem. Odszczepienie jednego protonu od cząsteczki witaminy C prowadzi do powstania anionu askorbinianowego (reakcja 1.). W wyniku oddania przez anion askorbinianowy elektronu i drugiego protonu powstaje rodnik askorbylowy (reakcja 2.). Wskutek utraty elektronu przez rodnik askorbylowy tworzy się kwas dehydroaskorbinowy (reakcja 3.).
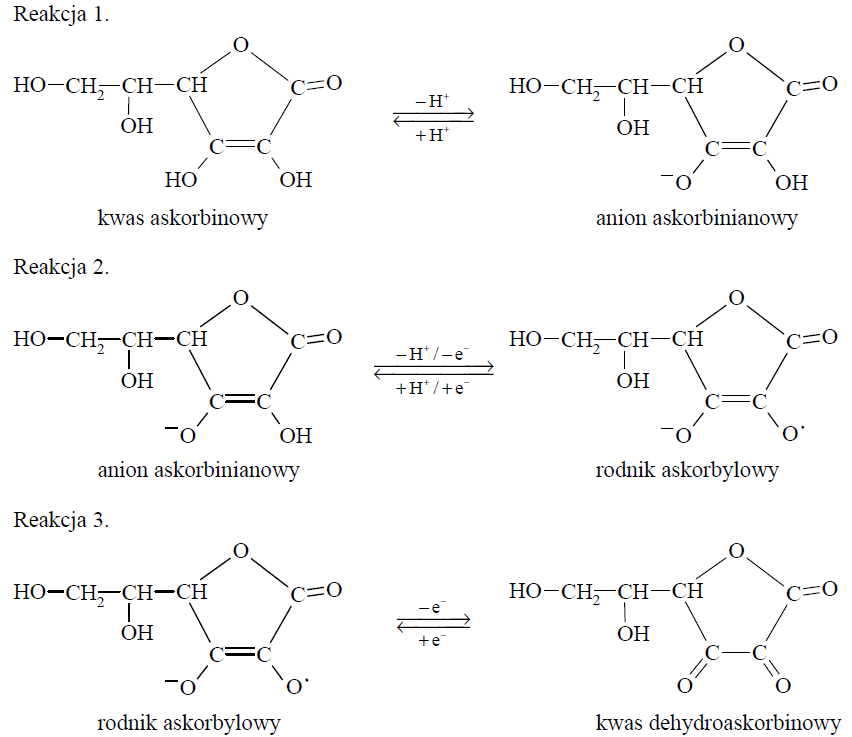
Na podstawie: J. Szymańska-Pasternak, A. Janicka, J. Bober, Witamina C jako oręż w walce z rakiem, „Onkologia w praktyce klinicznej”, 2011/1.
Oceń, czy poniższe informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa. 1. Anion askorbinianowy – w zależności od warunków reakcji – może przyłączać albo oddawać proton. 2. Rodnik askorbylowy jest reaktywny chemicznie, ponieważ występuje w nim jeden niesparowany elektron. 3. Kwas dehydroaskorbinowy jest produktem redukcji rodnika askorbylowego.
Zapis równań połówkowych reakcji utleniania oraz redukcji przebiegających podczas reakcji kwasu askorbinowego z tlenem. Zadanie 37. Arkusz CKE chemia maj 2016 rozszerzony (1 punkt)
Kwas askorbinowy ulega przemianie w kwas dehydroaskorbinowy zgodnie z poniższym schematem. Odszczepienie jednego protonu od cząsteczki witaminy C prowadzi do powstania anionu askorbinianowego (reakcja 1.). W wyniku oddania przez anion askorbinianowy elektronu i drugiego protonu powstaje rodnik askorbylowy (reakcja 2.). Wskutek utraty elektronu przez rodnik askorbylowy tworzy się kwas dehydroaskorbinowy (reakcja 3.).

Na podstawie: J. Szymańska-Pasternak, A. Janicka, J. Bober, Witamina C jako oręż w walce z rakiem, „Onkologia w praktyce klinicznej”, 2011/1.
Poniżej przedstawiono schemat reakcji utleniania witaminy C tlenem z powietrza. Reakcja ta jest katalizowana przez enzym o nazwie oksydaza askorbinianowa.
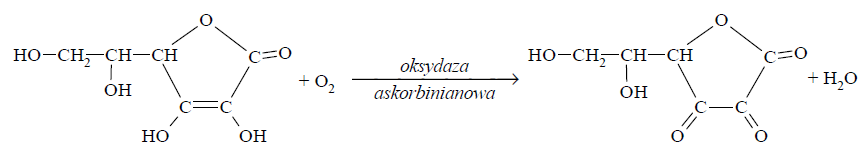
Napisz równanie procesu utleniania (uzupełnij schemat) i równanie procesu redukcji zachodzących podczas opisanej przemiany. Oba równania przedstaw w formie jonowej z uwzględnieniem liczby oddawanych lub pobieranych elektronów (zapis jonowo-elektronowy). Równanie procesu utleniania: Równanie procesu redukcji: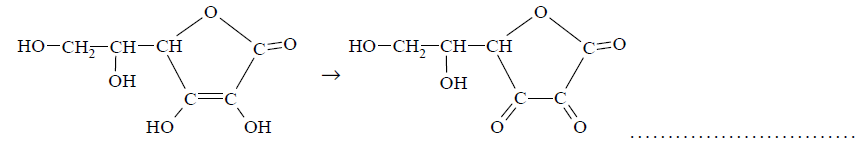
Zapis wzoru grupowego produktu reakcji kwasu askorbinowego z roztworem zasady sodowej. Zadanie 38. Arkusz CKE chemia maj 2016 rozszerzony (1 punkt)
Kwas askorbinowy ulega przemianie w kwas dehydroaskorbinowy zgodnie z poniższym schematem. Odszczepienie jednego protonu od cząsteczki witaminy C prowadzi do powstania anionu askorbinianowego (reakcja 1.). W wyniku oddania przez anion askorbinianowy elektronu i drugiego protonu powstaje rodnik askorbylowy (reakcja 2.). Wskutek utraty elektronu przez rodnik askorbylowy tworzy się kwas dehydroaskorbinowy (reakcja 3.).

Na podstawie: J. Szymańska-Pasternak, A. Janicka, J. Bober, Witamina C jako oręż w walce z rakiem, „Onkologia w praktyce klinicznej”, 2011/1.
Roztwór wodny kwasu dehydroaskorbinowego ma odczyn obojętny. Kwas ten ulega jednak działaniu wodnych roztworów wodorotlenków metali, w wyniku czego tworzą się sole. W tej reakcji rozerwaniu ulega wiązanie estrowe, co prowadzi do otwarcia pierścienia cząsteczki.
Uzupełnij podany niżej schemat opisanej reakcji – wpisz wzór półstrukturalny (grupowy) jej organicznego produktu.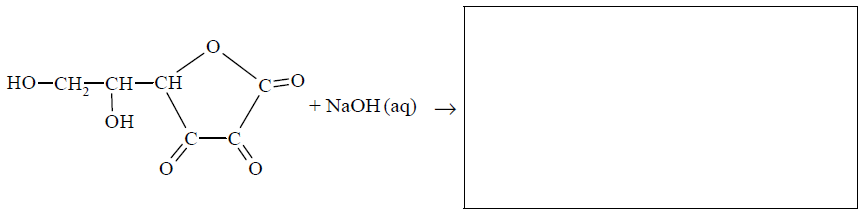
Zapis równań reakcji acetamidu z roztworem kwasu oraz zasady. Zadanie 39.1. Arkusz CKE chemia maj 2016 rozszerzony (2 punkty)
Mocznik jest diamidem kwasu węglowego. Ogrzewany z roztworami mocnych kwasów i z zasadami, ulega przemianom zilustrowanym poniższymi równaniami:
CO(NH2)2 + H2O + 2H+ → 2NH4+ + CO2
CO(NH2) 2 + 2OH− → CO32− + 2NH3
W celu porównania właściwości acetamidu i mocznika przeprowadzono dwa doświadczenia A i B zilustrowane na schemacie.
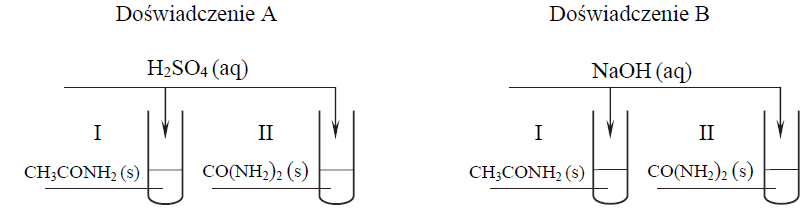
Po zmieszaniu reagentów zawartość każdej probówki ogrzano. Stwierdzono, że we wszystkich probówkach przebiegły reakcje chemiczne.
Napisz w formie jonowej skróconej równanie reakcji zachodzącej podczas ogrzewania acetamidu Doświadczenie A, probówka I: Doświadczenie B, probówka I:
• w wodnym roztworze kwasu siarkowego(VI) (doświadczenie A, probówka I)
• w wodnym roztworze wodorotlenku sodu (doświadczenie B, probówka I).
Wybór doświadczenia pozwalającego na odróżnienie acetamidu od mocznika wraz z uzasadnieniem wyboru. Zadanie 39.2. Arkusz CKE chemia maj 2016 rozszerzony (1 punkt)
Mocznik jest diamidem kwasu węglowego. Ogrzewany z roztworami mocnych kwasów i z zasadami, ulega przemianom zilustrowanym poniższymi równaniami:
CO(NH2)2 + H2O + 2H+ → 2NH4+ + CO2
CO(NH2) 2 + 2OH− → CO32− + 2NH3
W celu porównania właściwości acetamidu i mocznika przeprowadzono dwa doświadczenia A i B zilustrowane na schemacie.

Po zmieszaniu reagentów zawartość każdej probówki ogrzano. Stwierdzono, że we wszystkich probówkach przebiegły reakcje chemiczne.
Oceń, które z przeprowadzonych doświadczeń (A czy B) można wykorzystać w celu odróżnienia acetamidu od mocznika, i uzasadnij swoje stanowisko. W uzasadnieniu odwołaj się do zmian możliwych do zaobserwowania w probówkach I i II (w wybranym doświadczeniu) i pozwalających na odróżnienie acetamidu od mocznika. W celu odróżnienia acetamidu od mocznika należy przeprowadzić doświadczenie: Uzasadnienie: Probówka I: Probówka II:
Ocena poprawności zdań dotyczących wybranych aminokwasów. Zadanie 40. Arkusz CKE chemia maj 2016 rozszerzony (1 punkt)
Oceń, czy podane poniżej informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa.
1. Leucyna i izoleucyna są izomerami. 2. Jedyną przyczyną różnicy wartości punktu izoelektrycznego kwasu glutaminowego i lizyny jest różna długość łańcucha węglowego w cząsteczkach tych związków. 3. W cząsteczce treoniny można wyróżnić dwa asymetryczne atomy węgla.
Zapis sekwencji aminokwasów z wykorzystaniem ich trójliterowych oznaczeń na podstawie wzoru grupowego cząsteczki peptydu. Zadanie 41. Arkusz CKE chemia maj 2016 rozszerzony (1 punkt)
Jednym z naturalnie występujących tripeptydów jest związek o poniższym wzorze.
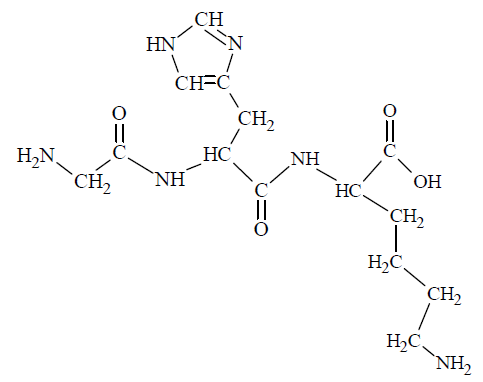
Napisz wzór sekwencji przedstawionego tripeptydu, posługując się trzyliterowymi kodami aminokwasów. Pamiętaj, że w tej notacji z lewej strony umieszcza się kod aminokwasu, którego reszta zawiera wolną grupę aminową połączoną z atomem węgla α.
Uzupełnienie treści zdań informacjami na temat struktury elektronowej bromu oraz jego stopni utlenienia. Zadanie 1. Arkusz CKE chemia maj 2015 rozszerzony (1 punkt)
Brom występuje w przyrodzie w postaci mieszaniny dwóch izotopów o masach atomowych równych 78,92 u i 80,92 u. Średnia masa atomowa bromu jest równa 79,90 u. Pierwiastek ten w reakcjach utleniania i redukcji może pełnić funkcję zarówno utleniacza, jak i reduktora. Tworzy związki chemiczne, w których występują różne rodzaje wiązań.
Uzupełnij poniższy tekst, wpisując w odpowiednie miejsca informacje dotyczące struktury elektronowej atomu bromu i jego stopni utlenienia. 1. Atom bromu w stanie podstawowym ma konfigurację elektronową , a w powłoce walencyjnej tego 2. Minimalny stopień utlenienia, jaki przyjmuje brom w związkach chemicznych, jest równy , a maksymalny wynosi .
atomu znajduje się elektronów. Brom należy do bloku konfiguracyjnego układu okresowego.
Obliczanie bezwzględnej masy jednej cząsteczki bromu. Zadanie 2. Arkusz CKE chemia maj 2015 rozszerzony (1 punkt)
Brom występuje w przyrodzie w postaci mieszaniny dwóch izotopów o masach atomowych równych 78,92 u i 80,92 u. Średnia masa atomowa bromu jest równa 79,90 u. Pierwiastek ten w reakcjach utleniania i redukcji może pełnić funkcję zarówno utleniacza, jak i reduktora. Tworzy związki chemiczne, w których występują różne rodzaje wiązań.
Mol jest jednostką liczności (ilości) materii. Liczbę drobin odpowiadającą jednemu molowi nazywamy liczbą Avogadra.
Oblicz bezwzględną masę (wyrażoną w gramach) pojedynczej cząsteczki bromu zbudowanej z atomów dwóch różnych izotopów.
Obliczanie procentowego składu izotopowego bromu. Zadanie 3. Arkusz CKE chemia maj 2015 rozszerzony (1 punkt)
Brom występuje w przyrodzie w postaci mieszaniny dwóch izotopów o masach atomowych równych 78,92 u i 80,92 u. Średnia masa atomowa bromu jest równa 79,90 u. Pierwiastek ten w reakcjach utleniania i redukcji może pełnić funkcję zarówno utleniacza, jak i reduktora. Tworzy związki chemiczne, w których występują różne rodzaje wiązań.
Oblicz, jaki procent atomów bromu występujących w przyrodzie stanowią atomy o masie atomowej 78,92 u, a jaki procent – atomy o masie atomowej 80,92 u.
Wskazanie typów wiązań występujących w trzech wybranych związkach chemicznych bromu. Zadanie 4. Arkusz CKE chemia maj 2015 rozszerzony (1 punkt)
Brom występuje w przyrodzie w postaci mieszaniny dwóch izotopów o masach atomowych równych 78,92 u i 80,92 u. Średnia masa atomowa bromu jest równa 79,90 u. Pierwiastek ten w reakcjach utleniania i redukcji może pełnić funkcję zarówno utleniacza, jak i reduktora. Tworzy związki chemiczne, w których występują różne rodzaje wiązań.
Ustal i wpisz do tabeli, jaki rodzaj wiązania (kowalencyjne niespolaryzowane, kowalencyjne spolaryzowane, jonowe) występuje w wymienionych związkach. 
Określenie typu hybrydyzacji oraz geometrii cząsteczki tlenku siarki(VI). Zadanie 5.1. Arkusz CKE chemia maj 2015 rozszerzony (1 punkt)
Budowa cząsteczki tlenku siarki(VI) jest skomplikowana. Poniżej przedstawiono jeden ze wzorów opisujących strukturę elektronową SO3.
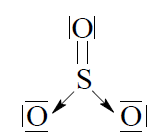
Określ typ hybrydyzacji orbitali atomu siarki (sp, sp2, sp3) i geometrię cząsteczki (liniowa, płaska, tetraedryczna). Typ hybrydyzacji: Geometria:
Określanie liczb wiązań sigma oraz pi w cząsteczce tlenku siarki(VI). Zadanie 5.2. Arkusz CKE chemia maj 2015 rozszerzony (1 punkt)
Budowa cząsteczki tlenku siarki(VI) jest skomplikowana. Poniżej przedstawiono jeden ze wzorów opisujących strukturę elektronową SO3.

Napisz, ile wiązań σ i π występuje w cząsteczce SO3 o przedstawionej powyżej strukturze. Liczba wiązań σ: Liczba wiązań π:
Wyjaśnienie dlaczego KCl oraz NaCl nie mogą tworzyć kryształów mieszanych. Zadanie 6. Arkusz CKE chemia maj 2015 rozszerzony (1 punkt)
Substancje o tym samym typie wzoru chemicznego, tworzące ten sam typ sieci przestrzennej i o takich samych lub bardzo zbliżonych rozmiarach komórki elementarnej, nazywamy substancjami izomorficznymi. Mogą one tworzyć roztwory stałe, czyli kryształy mieszane. Tworzenie kryształów mieszanych polega na tym, że atomy lub jony wykazujące taki sam ładunek oraz zbliżone rozmiary mogą się wzajemnie zastępować w sieci przestrzennej. KCl i KBr mają identyczne sieci przestrzenne i wykazują zdolność tworzenia stałych roztworów. Natomiast w przypadku KCl i NaCl izomorfizm nie występuje mimo tego samego typu sieci.
W tabeli podano wielkości promienia jonowego czterech jonów.

Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2002.
Wyjaśnij, dlaczego chlorek potasu i chlorek sodu nie mogą tworzyć kryształów mieszanych.

