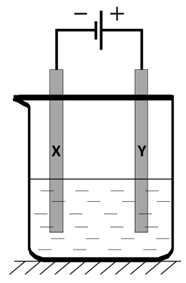
Wybór poprawnych określeń dotyczących elektrolizy roztworów siarczanu(VI) miedzi(II) przy użyciu różnych elektrod (elektroliza)
W dwóch elektrolizerach przez 18 minut prowadzono elektrolizę wodnego roztworu siarczanu(VI) miedzi(II) prądem o natężeniu 795 mA, przy czym w pierwszym z urządzeń zastosowano elektrody miedziane, a w drugim platynowe. Stężenia oraz objętości poddanych elektrolizie roztworów były jednakowe i wynosiły odpowiednio 0,1 mol·dm–3 oraz 400 cm3.
Podkreśl wyrażenia w nawiasach tak, aby powstały zdania prawdziwe. W pierwszym z elektrolizerów masa anody (wzrosła/zmalała/nie uległa zmianie), natomiast w drugim (wzrosła/zmalała/nie uległa zmianie). W tym samym czasie, w (każdym/jednym) z elektrolizerów, w przestrzeni katodowej przebiegł proces (utleniania miedzi/redukcji jonów Cu2+), dlatego masa katody w tym elektrolizerze (zmalała/nie uległa zmianie/wzrosła). © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie objętości mieszaniny gazów wydzielonych podczas elektrolizy przy określonej wydajności prądowej (elektroliza)
W dwóch elektrolizerach przez 18 minut prowadzono elektrolizę wodnego roztworu siarczanu(VI) miedzi(II) prądem o natężeniu 795 mA, przy czym w pierwszym z urządzeń zastosowano elektrody miedziane, a w drugim platynowe. Stężenia oraz objętości poddanych elektrolizie roztworów były jednakowe i wynosiły odpowiednio 0,1 mol·dm–3 oraz 400 cm3.
Produktem ubocznym w pierwszym elektrolizerze była mieszanina gazów.
Oblicz jej objętość w temperaturze 25 oC pod ciśnieniem 1020 hPa, jeśli w warunkach prowadzonego procesu wydajność prądowa wydzielania każdego z gazów wyniosła 5%. Wynik podaj w centymetrach sześciennych, z dokładnością do cyfry jedności. Przyjmij, że uniwersalna stała gazowa ma wartość 83,1 hPa∙dm³∙mol–1∙K–1, natomiast stała Faradaya 96500 C. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie liczby jonów miedzi(II) jakie pozostały po zakończeniu elektrolizy (elektroliza)
W dwóch elektrolizerach przez 18 minut prowadzono elektrolizę wodnego roztworu siarczanu(VI) miedzi(II) prądem o natężeniu 795 mA, przy czym w pierwszym z urządzeń zastosowano elektrody miedziane, a w drugim platynowe. Stężenia oraz objętości poddanych elektrolizie roztworów były jednakowe i wynosiły odpowiednio 0,1 mol·dm–3 oraz 400 cm3.
Policz liczbę moli jonów Cu2+ jakie pozostały w roztworze po zakończeniu elektrolizy w drugim z urządzeń. Przyjmij, że w warunkach prowadzonego procesu wydajność prądowa wydzielania miedzi wyniosła 90%. Wynik podaj z dokładnością do dwóch cyfr znaczących. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wyodrębnianie tlenku chromu(III) z mieszaniny poreakcyjnej uzyskanej w wyniku wstrzymania rozkładu dwuchromianu(VI) amonu
Na skalę laboratoryjną tlenek chromu(III) otrzymuje się podczas termicznego rozkładu dwuchromianu(VI) amonu:
(NH4)2Cr2O7 ⟶ Cr2O3 + N2 + 4H2O
Przez 10 sekund w tyglu porcelanowym prażono 12,6 g dwuchromianu(VI) amonu. Po tym czasie reakcję wstrzymano przez gwałtowne schłodzenie zawartości naczynia, a następnie ostrożnie odparowano powstałą wodę. Masa stałej pozostałości wynosiła 9,27 g.
Opisz w kilku zdaniach, w jaki sposób można odzyskać z mieszaniny poreakcyjnej tlenek chromu(III), powstały w warunkach opisanych w informacji wprowadzającej? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wyodrębnianie dwuchromianu(VI) amonu z mieszaniny poreakcyjnej uzyskanej w wyniku częściowego jego rozkładu
Na skalę laboratoryjną tlenek chromu(III) otrzymuje się podczas termicznego rozkładu dwuchromianu(VI) amonu:
(NH4)2Cr2O7 ⟶ Cr2O3 + N2 + 4H2O
Przez 10 sekund w tyglu porcelanowym prażono 12,6 g dwuchromianu(VI) amonu. Po tym czasie reakcję wstrzymano przez gwałtowne schłodzenie zawartości naczynia, a następnie ostrożnie odparowano powstałą wodę. Masa stałej pozostałości wynosiła 9,27 g.
Opisz w kilku zdaniach, w jaki sposób można odzyskać pozostały dwuchromian(VI) amonu z powstałej mieszaniny poreakcyjnej, jeśli wiadomo, że związek ten praktycznie nie rozpuszcza się w acetonie? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zapis równań reakcji redoks elektrolizy roztworu AgNO3 z wykorzystaniem elektrod srebrnych (elektroliza)
W dwóch elektrolizerach umieszczono wodny roztwór AgNO3 o stężeniu 0,2 mol∙dm–3 i przeprowadzono jego elektrolizę. W pierwszym naczyniu zastosowano elektrody srebrne, a w drugim – platynowe. W jednym z elektrolizerów proces prowadzono tak długo, aż w układzie (poza wodą) znajdował się również wyłącznie nowy, praktycznie całkowicie zdysocjowany na jony związek chemiczny.
Napisz równania połówkowe głównych reakcji redoks, jakie przebiegły podczas opisanego doświadczenia w przestrzeni katodowej oraz anodowej tego elektrolizera, w którym zastosowano elektrody srebrne. Przestrzeń katodowa: Przestrzeń anodowa: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wskazanie nazwy związku chemicznego, jaki powstał podczas elektrolizy roztworu AgNO3 z uzasadnieniem (elektroliza)
W dwóch elektrolizerach umieszczono wodny roztwór AgNO3 o stężeniu 0,2 mol∙dm–3 i przeprowadzono jego elektrolizę. W pierwszym naczyniu zastosowano elektrody srebrne, a w drugim – platynowe. W jednym z elektrolizerów proces prowadzono tak długo, aż w układzie (poza wodą) znajdował się również wyłącznie nowy, praktycznie całkowicie zdysocjowany na jony związek chemiczny.
Podaj nazwę związku chemicznego, którego roztwór uzyskano w wyniku przeprowadzonego procesu elektrolizy z udziałem elektrod platynowych. Uzasadnij swoją odpowiedź. Nazwa związku chemicznego: Uzasadnienie: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zapis równań reakcji chemicznych na podstawie przeprowadzonego eksperymentu z udziałem azotku magnezu
Na pewną ilość azotku magnezu (Mg3N2) podziałano w nadmiarze wodą z dodatkiem kilku kropli alkoholowego roztworu fenoloftaleiny. W opisanych warunkach prowadzonego doświadczenia oprócz wodorotlenku magnezu powstał również bezbarwny gaz o charakterystycznej, drażniącej woni, który zbierano w baloniku. Po zakończeniu reakcji balonik zamknięto, wypuszczono i zaobserwowano jego unoszenie się do góry. Pozostałą w kolbie mieszaninę wyprażono do stałej masy i uzyskano 10 g białej substancji, w której jony magnezowe stanowiły 60% (procenty wagowe).
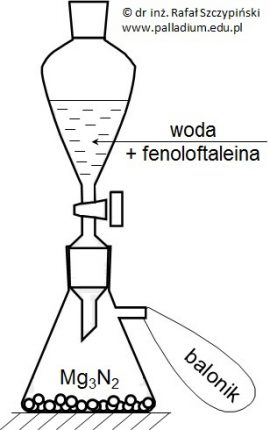
Napisz równania obu reakcji chemicznych i określ, jaką barwę przyjmie roztwór (faza wodna) uzyskany w wyniku przebiegu pierwszej z nich? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Ustalanie zawartości dwutlenku krzemu w próbce piasku
Wiadomo, że w skład próbki piasku o masie 20 g wchodzi dwutlenek krzemu oraz kalcyt – odmiana węglanu wapnia. Zawartość kalcytu bardzo często stanowi nawet 20% masy próbki.
Opisz, jak w sposób doświadczalny można ustalić udział procentowy (procent wagowy) dwutlenku krzemu w podanej masie próbki piasku, jeśli dostępne są dowolne odczynniki nieorganiczne oraz szkło i aparatura laboratoryjna? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zapis równań reakcji elektrodowych biegnących podczas procesu electroplatingu w fabryce płyt DVD (elektroliza)
Podczas jednego z etapów produkcji płyt DVD oraz Blu-ray prowadzi się proces zwany electroplatingiem. Na pełniącą wówczas funkcję katody płytkę niklową o średnicy 13 cm, umieszczoną w roztworze zawierającym jony Ni2+ nanosi się elektrolitycznie warstwę niklu (d = 8,91 g·cm–3, T = 25 oC). Anodą jest wówczas zanurzony w tym samym roztworze w postaci kulek nikiel, a opisany proces (w zależności od grubości docelowej warstwy) prowadzi się zwykle od 60 do 90 minut w stałej temperaturze. Powstała płyta ma kształt walca, o objętości V, którą wyraża wzór V = π·r2·h. W wyrażeniu tym r to długość promienia podstawy walca, natomiast h – wysokość tej figury przestrzennej.
Napisz w formie jonowej równania głównych procesów elektrodowych, jakie przebiegają podczas procesu electroplatingu. Reakcja katodowa: Reakcja anodowa: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie objętości gazu wydzielonego w wyniku elektrolizy wodorków sodu oraz potasu (elektroliza)
Stopy metali sporządza się w celu uzyskania określonych parametrów fizykochemicznych danego materiału. Niektóre z nich mogą mieć temperatury topnienia niższe, niż każdy ze składników z osobna. Przykładem może być mieszanina sodu z potasem, której temperatura topnienia wynosi –12,5 oC. W układzie takim znajduje się wówczas dwukrotnie więcej atomów tego pierwiastka chemicznego, który ma większą liczbę powłok elektronowych.
Na podstawie: K.-H. Lautenschläger i inni, Nowoczesne kompendium chemii, Warszawa 2018.
W celu przygotowania 75,75 g opisanego stopu potasu z sodem, w dwóch różnych elektrolizerach przeprowadzono elektrolizę stopionych wodorków wymienionych metali.
Oblicz, jaką objętość w przeliczeniu na warunki normalne zajął wydzielony podczas elektrolizy obu wodorków gaz? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone