Zapis równań reakcji chemicznych na podstawie przeprowadzonego eksperymentu z udziałem azotku magnezu
Na pewną ilość azotku magnezu (Mg3N2) podziałano w nadmiarze wodą z dodatkiem kilku kropli alkoholowego roztworu fenoloftaleiny. W opisanych warunkach prowadzonego doświadczenia oprócz wodorotlenku magnezu powstał również bezbarwny gaz o charakterystycznej, drażniącej woni, który zbierano w baloniku. Po zakończeniu reakcji balonik zamknięto, wypuszczono i zaobserwowano jego unoszenie się do góry. Pozostałą w kolbie mieszaninę wyprażono do stałej masy i uzyskano 10 g białej substancji, w której jony magnezowe stanowiły 60% (procenty wagowe).
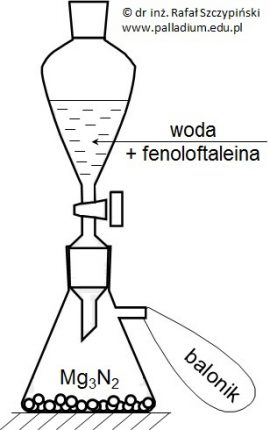
Napisz równania obu reakcji chemicznych i określ, jaką barwę przyjmie roztwór (faza wodna) uzyskany w wyniku przebiegu pierwszej z nich? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Ustalanie zawartości dwutlenku krzemu w próbce piasku
Wiadomo, że w skład próbki piasku o masie 20 g wchodzi dwutlenek krzemu oraz kalcyt – odmiana węglanu wapnia. Zawartość kalcytu bardzo często stanowi nawet 20% masy próbki.
Opisz, jak w sposób doświadczalny można ustalić udział procentowy (procent wagowy) dwutlenku krzemu w podanej masie próbki piasku, jeśli dostępne są dowolne odczynniki nieorganiczne oraz szkło i aparatura laboratoryjna? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zapis równań reakcji elektrodowych biegnących podczas procesu electroplatingu w fabryce płyt DVD (elektroliza)
Podczas jednego z etapów produkcji płyt DVD oraz Blu-ray prowadzi się proces zwany electroplatingiem. Na pełniącą wówczas funkcję katody płytkę niklową o średnicy 13 cm, umieszczoną w roztworze zawierającym jony Ni2+ nanosi się elektrolitycznie warstwę niklu (d = 8,91 g·cm–3, T = 25 oC). Anodą jest wówczas zanurzony w tym samym roztworze w postaci kulek nikiel, a opisany proces (w zależności od grubości docelowej warstwy) prowadzi się zwykle od 60 do 90 minut w stałej temperaturze. Powstała płyta ma kształt walca, o objętości V, którą wyraża wzór V = π·r2·h. W wyrażeniu tym r to długość promienia podstawy walca, natomiast h – wysokość tej figury przestrzennej.
Napisz w formie jonowej równania głównych procesów elektrodowych, jakie przebiegają podczas procesu electroplatingu. Reakcja katodowa: Reakcja anodowa: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie objętości gazu wydzielonego w wyniku elektrolizy wodorków sodu oraz potasu (elektroliza)
Stopy metali sporządza się w celu uzyskania określonych parametrów fizykochemicznych danego materiału. Niektóre z nich mogą mieć temperatury topnienia niższe, niż każdy ze składników z osobna. Przykładem może być mieszanina sodu z potasem, której temperatura topnienia wynosi –12,5 oC. W układzie takim znajduje się wówczas dwukrotnie więcej atomów tego pierwiastka chemicznego, który ma większą liczbę powłok elektronowych.
Na podstawie: K.-H. Lautenschläger i inni, Nowoczesne kompendium chemii, Warszawa 2018.
W celu przygotowania 75,75 g opisanego stopu potasu z sodem, w dwóch różnych elektrolizerach przeprowadzono elektrolizę stopionych wodorków wymienionych metali.
Oblicz, jaką objętość w przeliczeniu na warunki normalne zajął wydzielony podczas elektrolizy obu wodorków gaz? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie masy wapnia wydzielonego podczas elektrolizy w układzie szeregowego połączenia elektrolizerów (elektroliza)
Stopy metali sporządza się w celu uzyskania określonych parametrów fizykochemicznych danego materiału. Niektóre z nich mogą mieć temperatury topnienia niższe, niż każdy ze składników z osobna. Przykładem może być mieszanina sodu z potasem, której temperatura topnienia wynosi –12,5 oC. W układzie takim znajduje się wówczas dwukrotnie więcej atomów tego pierwiastka chemicznego, który ma większą liczbę powłok elektronowych.
Na podstawie: K.-H. Lautenschläger i inni, Nowoczesne kompendium chemii, Warszawa 2018.
W celu przygotowania 75,75 g opisanego stopu potasu z sodem, w dwóch różnych elektrolizerach przeprowadzono elektrolizę stopionych wodorków wymienionych metali.
Podczas połączenia szeregowego elektrolizerów, przez każdy nich przepływa ładunek elektryczny o takiej samej wartości. Elektrolizer, w którym wydzielono sód połączony był szeregowo z innym elektrolizerem – zawierającym stopiony chlorek wapnia.
Oblicz, masę wapnia, jaka mogła zostać maksymalnie wydzielona w wyniku elektrolizy tej soli. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie liczby jonów srebra zredukowanych podczas elektrolizy w układzie równoległego połączenia elektrolizerów (elektroliza)
Zgodnie z pierwszym prawem Kirchhoffa sumaryczne natężenie prądu elektrycznego przepływającego przez urządzenia połączone równolegle w obwodzie elektrycznym, równe jest natężeniu prądu elektrycznego jaki wypłynął z jego źródła.
Przeprowadzono elektrolizę wodnych roztworów – siarczanu(VI) miedzi(II) oraz azotanu(V) srebra z udziałem elektrod platynowych. W pierwszym z wymienionych elektrolizerów, które połączone były równolegle wydzielona miedź miała masę 41,6 g.
Wiedząc, że całkowity ładunek elektryczny jaki przepłynął przez obwód miał wartość 2,1 F, oszacuj liczbę jonów srebra jakie uległy redukcji w drugim elektrolizerze. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Ustalenie symbolu pierwiastka chemicznego na podstawie elektrolizy roztworów jego soli w układzie równoległego połączenia elektrolizerów (elektroliza)
Zgodnie z pierwszym prawem Kirchhoffa sumaryczne natężenie prądu elektrycznego przepływającego przez urządzenia połączone równolegle w obwodzie elektrycznym, równe jest natężeniu prądu elektrycznego jaki wypłynął z jego źródła.
W celu elektrolitycznego wydzielenia jednego mola pewnego pierwiastka metalicznego X należy dostarczyć ładunku elektrycznego o wartości 2 F. Podczas zajęć szkolnych połączono równolegle dwa elektrolizery. W pierwszym z nich znajdował się wodny roztwór bromku metalu X, a w drugim – jodek tego pierwiastka. Stwierdzono, że masa substancji wydzielonej na katodzie każdego z elektrolizerów była taka sama i wynosiła 2,6 g.
Ustal symbol pierwiastka X, jeśli wiadomo, że elektrolizę prowadzono przez dwie godziny lekcyjne prądem o natężeniu 2,85 A. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Ocena poprawności zdań dotyczących aminokwasu oraz hydroksyaldehydu (izomeria optyczna)
Rysunek poniżej przedstawia wzory chemiczne cząsteczek pewnych związków chemicznych.
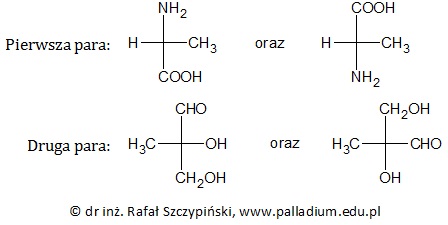
Oceń poprawność poniższych zdań dotyczących związków chemicznych, których wzory przedstawiono w informacji wprowadzającej. Wpisz literę „P” (prawda) lub literę „F” (fałsz). 1. Każda z narysowanych cząsteczek wykazuje czynność optyczną. 2. Pierwsza para stanowi związki chemiczne, których wodne roztwory mają odczyn obojętny. 3. Pierwszą parę związków chemicznych od drugiej pary można odróżnić stosując jako odczynnik wodny roztwór wodorowęglanu sodu. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wybór pary wzorów stanowiących tę samą cząsteczkę, ale inaczej narysowaną (izomeria optyczna)
Rysunek poniżej przedstawia wzory chemiczne cząsteczek pewnych związków chemicznych.

Spośród narysowanych wzorów związków organicznych wybierz parę przedstawiającą tę samą cząsteczkę, ale inaczej narysowaną, a następnie uwzględniając właściwy szereg konfiguracyjny (L lub D) podaj jej nazwę systematyczną. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wybór określonego związku chemicznego będącego produktem procesu wypieku ciasta z uzasadnieniem wyboru
W skład proszku do pieczenia wchodzą zwykle dwa związki chemiczne – wodorowęglan sodu (soda oczyszczona) lub wodorowęglan amonu (tzw. amoniak do pieczenia). W temperaturze wypieku równej 180 ⁰C oba rozkładają się z wydzieleniem gazowych produktów, przy czym podczas rozkładu sody oczyszczonej powstaje dodatkowo związek chemiczny o stałym stanie skupienia, zawierający 43,4% sodu.
Do wypieku 600 g ciasta (1000 hPa) wykorzystano 15 g wodorowęglanu amonu. Gazowe produkty reakcji jego rozkładu spowodowały spulchnienie ciasta.
Który spośród produktów reakcji rozkładu amoniaku do pieczenia pierwszy opuści piekarnik, a który ostatni? Uwzględnij wyłącznie te związki chemiczne, które w warunkach normalnych są gazami. Uzasadnij swoje stanowisko. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone