Zapis barwy fazy ciekłej z uzasadnieniem równaniem procesu zapisanym w formie jonowej skróconej
Rozkładowi termicznemu poddano próbkę węglanu berylu o masie 3,45 g. Wydzielający się gaz wprowadzano do znajdującego się w zlewce klarownego roztworu wody wapiennej o objętości 500 cm3, zawierającego 740 mg wodorotlenku wapnia i fenoloftaleinę. Schemat opisanego doświadczenia ilustruje rysunek poniżej.
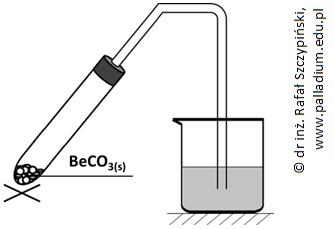
Po całkowitym rozkładzie węglanu berylu stwierdzono, że barwa fazy ciekłej w zlewce była taka sama jak przed rozpoczęciem doświadczenia.
Jaki kolor miała faza ciekła w tym naczyniu po zakończeniu eksperymentu? Odpowiedź uzasadnij równaniem procesu chemicznego zapisanym w formie jonowej skróconej. Barwa: Równanie procesu: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zapis równań reakcji chemicznych z udziałem kwasu bromowodorowego z dwiema solami wapniowymi
Rozkładowi termicznemu poddano próbkę węglanu berylu o masie 3,45 g. Wydzielający się gaz wprowadzano do znajdującego się w zlewce klarownego roztworu wody wapiennej o objętości 500 cm3, zawierającego 740 mg wodorotlenku wapnia i fenoloftaleinę. Schemat opisanego doświadczenia ilustruje rysunek poniżej.

Po całkowitym rozkładzie węglanu berylu, ze zlewki odparowano wodę uzyskując mieszaninę dwóch soli wapniowych. Do opisanego układu wprowadzono następnie nadmiar wodnego roztworu bromowodoru i zaobserwowano intensywne pienienie się zawartości naczynia.
Napisz równanie reakcji chemicznej z udziałem każdej z soli, której przebiegowi towarzyszył opisany objaw. 1.: 2.: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie odczynu roztworu uzyskanego po zmieszaniu siarkowodoru z roztworem zasady sodowej z uzasadnieniem
Do 200 g wodnego 20-procentowego roztworu wodorotlenku sodu wprowadzono 11,2 dm3 odmierzonego w warunkach normalnych siarkowodoru.
Wykonaj niezbędne obliczenia i ustal odczyn uzyskanego roztworu. Odpowiedź uzasadnij równaniem odpowiedniego procesu zapisanym w formie jonowej skróconej. Odczyn roztworu: Równanie procesu: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Reakcja roztworu węglanu amonu z wodnym roztworem kwasu siarkowego(VI) oraz wodorotlenku sodu
Reakcja sproszkowanego węglanu amonu z rozcieńczonym kwasem siarkowym(VI) przebiega bardzo gwałtownie, o czym świadczy intensywnie wydzielający się gaz. Działając na ten sam związek chemiczny wodnym roztworem wodorotlenku sodu nie obserwujemy pęcherzyków wydzielającego się gazu.
Wodny roztwór węglanu amonu rozdzielono do dwóch probówek. Do pierwszej z nich wprowadzono następnie roztwór kwasu siarkowego(VI), a do drugiej – wodny roztwór wodorotlenku sodu.
Napisz w formie jonowej skróconej równania reakcji chemicznych, jakie przebiegły w każdym z naczyń reakcyjnych. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Reakcja węglanu amonu z wodnym roztworem kwasu siarkowego(VI) oraz wodorotlenku sodu
Reakcja sproszkowanego węglanu amonu z rozcieńczonym kwasem siarkowym(VI) przebiega bardzo gwałtownie, o czym świadczy intensywnie wydzielający się gaz. Działając na ten sam związek chemiczny wodnym roztworem wodorotlenku sodu nie obserwujemy pęcherzyków wydzielającego się gazu. Rodzaj gazowego produktu można wówczas zidentyfikować trzymając u wylotu naczynia zwilżony wodą papierek wskaźnikowy.
Wyjaśnij, dlaczego podczas działania wodnego roztworu wodorotlenku sodu na sproszkowany węglan amonu nie odnotowuje się wyżej opisanych objawów reakcji? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Usuwanie gazowego, dobrze rozpuszczalnego produktu z mieszaniny poreakcyjnej
Reakcja sproszkowanego węglanu amonu z rozcieńczonym kwasem siarkowym(VI) przebiega bardzo gwałtownie, o czym świadczy intensywnie wydzielający się gaz. Działając na ten sam związek chemiczny wodnym roztworem wodorotlenku sodu nie obserwujemy pęcherzyków wydzielającego się gazu. Rodzaj gazowego produktu można wówczas zidentyfikować trzymając u wylotu naczynia zwilżony wodą papierek wskaźnikowy.
W jaki sposób można ze względnie wysoką wydajnością usunąć amoniak z mieszaniny poreakcyjnej? Uzasadnij odpowiedź. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zapis równania reakcji chemicznej będącej podstawą odróżnienia próbek kainitu oraz karnalitu
Do minerałów o stosunkowo dużej zawartości magnezu należą – kainit, o wzorze KCl·MgSO4·3H2O oraz karnalit – KCl·MgCl2·6H2O.
Na podstawie: K.-H. Lautenschläger i inni, Nowoczesne kompendium chemii, Warszawa 2018.
W dwóch różnych probówkach losowo umieszczono próbki kainitu oraz karnalitu. W celu odróżnienia zawartości każdej z nich, próbki całkowicie rozpuszczono w wodzie, a następnie wykonano doświadczenie chemiczne podczas którego wykorzystano jeden z odczynników:
NaBr(aq), KOH(aq), AgNO3(aq), BaCl2(aq).
Napisz w formie jonowej skróconej równanie reakcji chemicznej stanowiącej podstawę odróżnienia próbek. Napisz, co zaobserwowano w każdej z probówek? Równanie reakcji: Obserwacje (próbka kainitu): Obserwacje (próbka karnalitu): © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zapis równania reakcji chemicznej jaka doprowadziła do powstania ciemniejącego osadu
Do minerałów o stosunkowo dużej zawartości magnezu należą – kainit, o wzorze KCl·MgSO4·3H2O oraz karnalit – KCl·MgCl2·6H2O.
Na podstawie: K.-H. Lautenschläger i inni, Nowoczesne kompendium chemii, Warszawa 2018.
Próbkę jednego z minerałów rozpuszczono w takiej ilości wody, że uzyskano roztwór o stosunkowo wysokim stężeniu znajdujących się w nim drobin. Następnie do tak uzyskanej mieszaniny wprowadzono jeden spośród odczynników: Pb(NO3)2(aq), AgNO3(aq), Ca(OH)2(aq), KOH(aq), CaBr2(aq). Zaobserwowano wówczas, że wytrącił się biały, serowaty osad, który z czasem stał się ciemniejszy. Napisz w formie jonowej skróconej równanie pierwszej reakcji chemicznej jaka przebiegła. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wyjaśnienie szybszego odwodnienia mieszaniny hydratów umieszczonej na płytce ceramicznej
Z pojemnika zawierającego 250 g mieszaniny dwóch hydratów: CuSO4 · 3H2O oraz CuSO4 · 5H2O odważono dwie próbki o masie 7,32 g każda. Pierwszą z nich umieszczono w tyglu porcelanowym, a drugą rozłożono równomiernie na ceramicznej płytce wykonanej z tego samego materiału, co tygiel. Obie próbki wprowadzono do pieca i poddano całkowitemu odwodnieniu w temperaturze 170 oC. Po zakończeniu doświadczenia stwierdzono, że masy uzyskanych w obu naczyniach białych substancji stałych stanowiły po 65,6% masy każdej z mieszanin poddanych prażeniu.
Podczas przeprowadzonego eksperymentu stwierdzono, że jedna z próbek szybciej osiągnęła stałą masę.
Określ, która była to próbka? Uzasadnij swoją odpowiedź. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określenie wzoru sumarycznego, modelu hybrydyzacji i liczby wiązań σ oraz π. Zadanie 1. Arkusz CKE chemia maj 2019 rozszerzony (1 punkt)
Dwa pierwiastki oznaczono umownie literami X i Z. Dwuujemny jon pierwiastka Z ma konfigurację elektronową 1s22s22p63s23p6 w stanie podstawowym. Pierwiastki X i Z tworzą związek XZ2, w którym stosunek masowy pierwiastka X do pierwiastka Z jest równy 3 : 16. Cząsteczka tego związku ma budowę liniową.
Napisz wzór sumaryczny związku opisanego w informacji, zastępując umowne oznaczenia X i Z symbolami pierwiastków. Podaj typ hybrydyzacji (sp, sp2, sp3) orbitali walencyjnych atomu pierwiastka X tworzącego związek XZ2 oraz napisz liczbę wiązań typu σ i liczbę wiązań typu π występujących w cząsteczce opisanego związku chemicznego. Wzór sumaryczny: Typ hybrydyzacji: Liczba wiązań typu σ: Liczba wiązań typu π:

