Zapis równań reakcji wydzielania gazu z udziałem związków nieorganicznych
Przeprowadzono pięć reakcji chemicznych, do przebiegu których zastosowano stechiometryczne ilości reagentów. W pierwszym naczyniu znajdowało się mleko wapienne (wodna zawiesina wodorotlenku wapnia), w probówkach o numerach 2, 3 i 4 umieszczono stężone roztwory soli. W probówce nr 5 znajdował się rozcieńczony roztwór kwasu azotowego(V). Schemat opisanego doświadczenia zilustrowano poniższym rysunkiem:
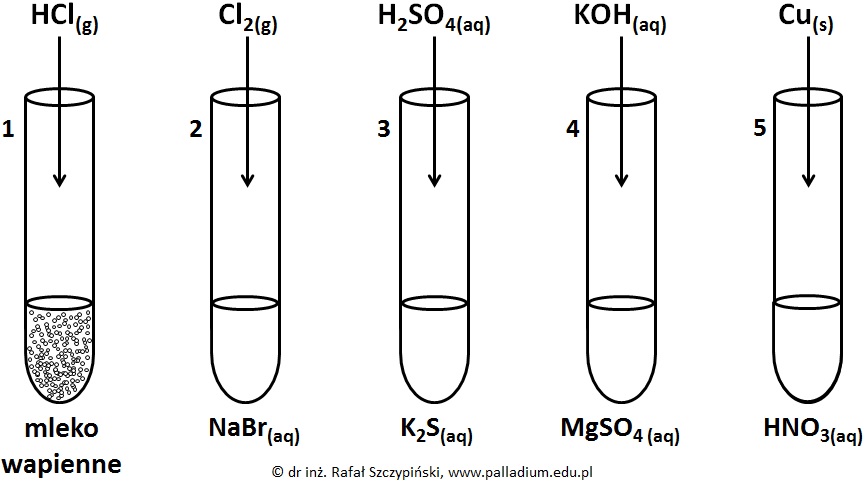
Napisz w formie jonowej skróconej równania tych reakcji chemicznych, w wyniku przebiegu których powstały substancje gazowe. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie barw zawartości naczyń po zakończeniu doświadczenia przeprowadzonego z udziałem substancji nieorganicznych
Przeprowadzono pięć reakcji chemicznych, do przebiegu których zastosowano stechiometryczne ilości reagentów. W pierwszym naczyniu znajdowało się mleko wapienne (wodna zawiesina wodorotlenku wapnia), w probówkach o numerach 2, 3 i 4 umieszczono stężone roztwory soli. W probówce nr 5 znajdował się rozcieńczony roztwór kwasu azotowego(V). Schemat opisanego doświadczenia zilustrowano poniższym rysunkiem:

Podaj numery tych probówek, w których zaobserwowano zmiany barwy ich zawartości po dodaniu odczynnika. Napisz, na czym polegały te zmiany? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Reakcja roztworu wodorotlenku sodu z produktem reakcji kwasu ortofosforowego(V) z azotanem(III) sodu
Przeprowadzono dwa doświadczenia chemiczne pod ciśnieniem normalnym otoczenia i w stałej jego temperaturze.
Doświadczenie nr 1: do probówki ze sproszkowanym azotanem(III) sodu dodano niewielki nadmiar 25% roztworu kwasu ortofosforowego(V). Barwny, gazowy produkt, będący produktem reakcji częściowo opuścił naczynie reakcyjne.
Doświadczenie nr 2: po zakończeniu reakcji z doświadczenia nr 1, do jednej trzeciej pojemności probówki dodano nadmiar stężonego roztworu wodorotlenku sodu. Następnie probówkę szczelnie zamknięto i kilka razy wstrząśnięto energicznie bez otwierania. Na koniec zawartość naczynia doprowadzono do temperatury otoczenia.
Jaką barwę miała zawartość probówki po zakończeniu doświadczenia nr 2? Odpowiedź uzasadnij równaniem reakcji chemicznej, jeśli w wyniku jej przebiegu powstaje mieszanina soli dwóch kwasów tlenowych oraz woda. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wskazanie wzorów kwasów oraz zasad Lewisa wśród substratów czterech reakcji chemicznych
Zgodnie z elektronową teorią kwasów i zasad Lewisa, kwasem jest drobina zdolna do przyłączenia pary elektronowej, a zasadą jest wówczas donor takiej pary.
W tabeli poniżej przedstawiono równania kilku reakcji chemicznych.
W puste pola wpisz wzory tych cząsteczek lub jonów stanowiących substraty opisanych przemian, które pełnią w nich rolę kwasów i zasad w teorii Lewisa. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone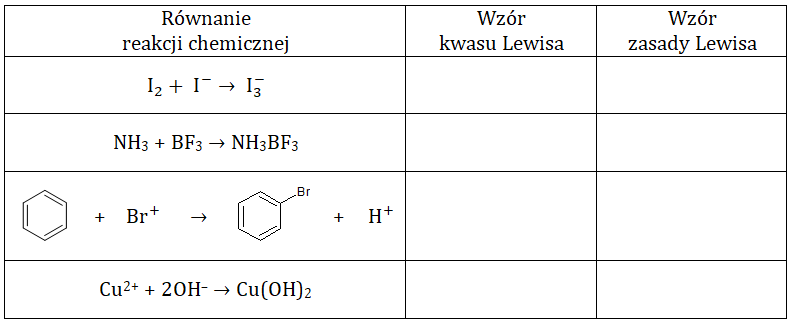
Zapis równania reakcji anionu tlenkowego z wodą z zapisem elektronowych wzorów drobin
Zgodnie z elektronową teorią kwasów i zasad Lewisa, kwasem jest drobina zdolna do przyłączenia pary elektronowej, a zasadą jest wówczas donor takiej pary.
Na skutek reakcji biegnącej między cząsteczką wody a anionem tlenkowym, podczas działania wodą na tlenek litowca dochodzi do zniszczenia sieci krystalicznej tlenku.
Stosując wzory elektronowe odpowiednich cząsteczek oraz jonów napisz równanie opisanej reakcji chemicznej. Wskaż wzór sumaryczny drobiny, która pełnij w tej przemianie rolę kwasu oraz drobiny będącej zasadą Lewisa. Równanie reakcji: Kwas Lewisa: Zasada Lewisa: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zapis wzoru sumarycznego soli powstałej w wyniku reakcji wodorotlenku sodu z kwasem siarkowym(VI)
Do wodnego roztworu kwasu siarkowego(VI) zawierającego 5,88 g kwasu wprowadzono 2,4 g wodorotlenku sodu i energicznie wstrząśnięto zawartością naczynia reakcyjnego. Po całkowitym roztworzeniu się ciała stałego z uzyskanego roztworu odparowano wodę.
Napisz wzór sumaryczny soli, jaka powstała. Odpowiedź uzasadnij niezbędnymi obliczeniami. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
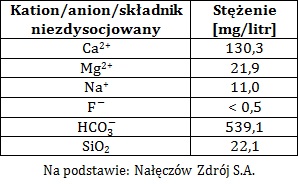
Określanie stężenia molowego roztworu sacharozy na podstawie próby Trommera produktów reakcji hydrolizy tego disacharydu
Sacharozę znajdującą się w 100 cm3 wodnego roztworu poddano reakcji hydrolizy wobec kwasu solnego. Po jej zakończeniu i odparowaniu rozpuszczalnika, krystaliczną substancję stałą o masie 56,96 g rozpuszczono w wodzie i ponownie uzyskano 100 cm3 roztworu. Z roztworu tego pobrano następnie próbkę o objętości równej 25 cm3 i wykonano próbę Trommera, w wyniku której uzyskano 8,64 g ceglastego osadu.
Określ z dokładnością do dwóch cyfr znaczących stężenie molowe wyjściowego roztworu sacharozy. Rozwiązanie tego zadania dostępne jest nieodpłatnie pod poniższym linkiem: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
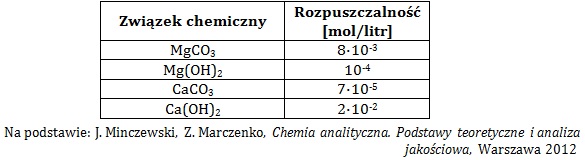
Zapis równania reakcji chemicznej przebiegającej podczas ogrzewania węglanu berylu
Rozkładowi termicznemu poddano próbkę węglanu berylu o masie 3,45 g. Wydzielający się gaz wprowadzano do znajdującego się w zlewce klarownego roztworu wody wapiennej o objętości 500 cm3, zawierającego 740 mg wodorotlenku wapnia i fenoloftaleinę. Schemat opisanego doświadczenia ilustruje rysunek poniżej.
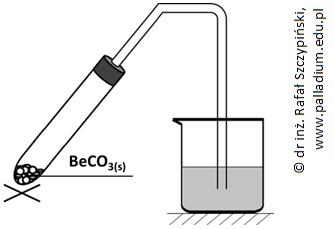
Gdy rozłożono 20% wyjściowej masy węglanu zaobserwowano w zlewce objaw świadczący o przebiegu reakcji chemicznej.
Napisz równanie reakcji chemicznej, jaka przebiegła w probówce podczas ogrzewania zawartego w niej węglanu berylu. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone