Obliczanie stężenia roztworu kwasu octowego do przygotowania roztworu buforu octanowego o określonej wartości pH (bufory)
Roztwory buforowe są układami złożonymi:
– ze słabego kwasu (HA) i jego soli (anion A–) pochodzącej od mocnej zasady, przy czym przyjmuje się, że stężenie jonu A– jest wówczas równe stężeniu soli,
– ze słabej zasady (B) i jej soli (kation BH+) pochodzącej od mocnego kwasu, przy czym przyjmuje się, że stężenie jonu BH+ jest wówczas równe stężeniu soli.
Dla opisanych układów buforowych istnieją zależności:
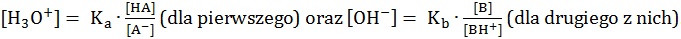
Rola bufora sprowadza się do utrzymania względnie stałego pH roztworu.
Na podstawie: P. W. Atkins, Chemia fizyczna, Warszawa 2012.
W kolbie miarowej o pojemności 250 cm3 umieszczono 4,1 g octanu sodu.
Oblicz, jakie powinno być stężenie molowe roztworu kwasu octowego, aby po napełnieniu nim kolby „do kreski”, pH uzyskanego w ten sposób buforu octanowego było równe 4,5? Wynik podaj z dokładnością do dwóch cyfr znaczących. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie odczynu roztworu wodnego wraz z uzasadnieniem wyboru właściwej substancji (hydroliza soli)
W tabeli poniżej zgromadzono dane na temat roztworów wodnych czterech związków chemicznych.

W jednym z wymienionych w tabeli roztworów za odczyn odpowiada proces inny, niż dysocjacja elektrolityczna. Podaj nazwę tego procesu oraz napisz, jaki odczyn ma znajdujący się w opisanym naczyniu roztwór? Odpowiedź uzasadnij równaniem chemicznym zapisanym w formie jonowej skróconej. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie procentu wagowego kwasu nadtlenosiarkowego w powstałym w wyniku reakcji chemicznej roztworze
W celu usunięcia pozostałości organicznych ze szkła laboratoryjnego stosuje się tzw. roztwór piranię (ang. piranha solution). Jest to mieszanina 96-procentowego roztworu kwasu siarkowego(VI) o gęstości 1,84 g/cm3 i perhydrolu, czyli 30-procentowego roztworu nadtlenku wodoru o gęstości 1,11 g/cm3. Oba składniki roztworu pirania miesza się w stosunku objętościowym (odpowiednio) 7:3, a produktem przebiegającej reakcji chemicznej jest kwas nadtlenosiarkowy (H2SO5) oraz woda.
Na podstawie: A. Asgar i inni, Photodefinable polydimethylsiloxane (PDMS) for rapid lab-on-a-chip prototyping, Lab on a Chip 2007.
Zakładając 100% wydajność przebiegającej reakcji chemicznej, oblicz procent wagowy kwasu nadtlenosiarkowego w uzyskanym roztworze. Wynik podaj z dokładnością do pierwszego miejsca po przecinku. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie stężenia molowego jonów w wodnym roztworze soli w którym przebiega hydroliza anionowa (hydroliza soli)
Rozważając równowagi jonowe w wodnych roztworach soli słabych kwasów i mocnych zasad lub mocnych kwasów i słabych zasad istnieje relacja: Ka·Kb = Kw. W przypadku roztworu zawierającego sól pochodzącą od słabego kwasu i mocnej zasady, wielkość Ka jest wówczas stałą równowagi dysocjacji kwasu Brønsteda, natomiast Kb to stała równowagi reakcji hydrolizy sprzężonej z nim zasady Brønsteda. Stała równowagi autodysocjacji wody (Kw) w temperaturze 25 ⁰C ma wartość około 10–14.
Na podstawie: P. W. Atkins, Chemia fizyczna, Warszawa 2012.
W kolbie miarowej o pojemności 500 cm3, w temperaturze 25 OC znajdował się roztwór octanu sodu o pH = 9 i nieznanym stężeniu molowym.
Oblicz stężenie znajdujących się w nim kationów sodu. Wynik podaj w mg·ml–1 z dokładnością do trzech cyfr znaczących. Rozwiązanie tego zadania dostępne jest nieodpłatnie pod poniższym linkiem: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Objętość roztworu kwasu azotowego(V) niezbędna do reakcji z mieszaniną węglanów
Na minerał zawierający po 0,1 mola każdego z węglanów: baru, srebra oraz wapnia podziałano stechiometryczną ilością stężonego roztworu kwasu azotowego(V). Zawartość naczynia ogrzewano, a po ochłodzeniu uzupełniono wodą do wyjściowej objętości roztworu.
Oblicz, jaka minimalna objętość (cm3) 63% roztworu kwasu azotowego(V) o gęstości 1,38 g·cm–3 powinna zostać użyta, w celu całkowitego przereagowania ze składnikami minerału o podanym w informacji wstępnej składzie? Wynik podaj z dokładnością do pierwszego miejsca po przecinku. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie objętości roztworu kwasu niezbędnej do zobojętnienia roztworu stanowiącego mieszaninę substancji
W pewnej objętości wody destylowanej rozpuszczono próbkę wodorotlenku sodu, w której zanieczyszczenia w postaci węglanu sodu stanowiły 4% masy. W ten sposób uzyskano 200 g roztworu o zawartości wodorotlenku sodu równej 12% wagowych.
Oblicz objętość 16% roztworu kwasu solnego o gęstości 1,07 g/cm3 niezbędną do zobojętnienia przygotowanego roztworu, który opisano w informacji wprowadzającej. Wynik obliczeń podaj w centymetrach sześciennych, z dokładnością do cyfry jedności. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie ilości substancji stałej oraz rozpuszczalnika, jakie trzeba zmieszać w celu uzyskania roztworu o określonym stężeniu
W pewnej objętości wody destylowanej rozpuszczono próbkę wodorotlenku sodu, w której zanieczyszczenia w postaci węglanu sodu stanowiły 4% masy. W ten sposób uzyskano 200 g roztworu o zawartości wodorotlenku sodu równej 12% wagowych.
Oblicz objętość wody destylowanej (d = 1 g/cm3) oraz masę próbki użytej do przygotowania roztworu o podanej w informacji wprowadzającej zawartości wodorotlenku. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie stężenia procentowego roztworu kwasu mlekowego powstałego w wyniku fermentacji laktozy (wydajność reakcji)
Mleko jest układem stanowiącym mieszaninę różnych substancji chemicznych, a jego gęstość wynosi zwykle 1,03 g/cm3. Za nieco słodki smak odpowiada obecność znajdującej się w nim laktozy – dwucukru o wzorze sumarycznym C12H22O11, który w mleku krowim stanowi około 4,6% masy. W sprzyjających warunkach, w obecności odpowiednich bakterii laktoza zostaje przekształcona w kwas mlekowy:
C12H22O11 + H2O ⟶ 4C3H6O3
Oblicz stężenie procentowe kwasu mlekowego w kwaśnym mleku uzyskanym w wyniku fermentacji laktozy zawartej w 1 litrze mleka krowiego, jeśli wydajność tego procesu wynosi 65%. Wynik podaj z dokładnością do trzech cyfr znaczących. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie stężenia molowego etanolu w roztworze powstałym w wyniku fermentacji alkoholowej glukozy
Jednym z płynów infuzyjnych jest wodny roztwór glukozy o stężeniu 50 mg·ml–1, dostępny w butelkach o pojemności 0,5 dm3. W sprzyjających warunkach cukier ten ulega fermentacji alkoholowej zgodnie z równaniem:
C6H12O6 ⟶ 2C2H5OH + 2CO2↑
Oblicz, jakie stężenie molowe mógłby osiągnąć powstały w wyniku fermentacji glukozy roztwór etanolu, jeśli wydajność takiego procesu wyniosłaby 36%? Przyjmij, że w trakcie procesu objętość roztworu praktycznie nie ulega zmianom. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone

