Określanie konfiguracji elektronowej pierwiastka z zaznaczeniem elektronów walencyjnych
O dwóch pierwiastkach chemicznych X i Y wiadomo, że w stanie podstawowym:
– elektronom walencyjnym ich izotopów przypisuje się wartość głównej liczby kwantowej równą cztery,
– atomy pierwiastka X mają dwukrotnie mniej elektronów walencyjnych, niż atomy pierwiastka Y,
– liczba ich walencyjnych elektronów sparowanych jest dwukrotnie większa od liczby elektronów niesparowanych.
Za pomocą symboli podpowłok zapisz pełną konfigurację elektronową pierwiastka X oraz podkreśl w niej fragment opisujący elektrony walencyjne. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zapis skróconej konfiguracji elektronowej pierwiastka na podstawie opisu rozmieszczenia jego elektronów walencyjnych
O dwóch pierwiastkach chemicznych X i Y wiadomo, że w stanie podstawowym:
– elektronom walencyjnym ich izotopów przypisuje się wartość głównej liczby kwantowej równą cztery,
– atomy pierwiastka X mają dwukrotnie mniej elektronów walencyjnych, niż atomy pierwiastka Y,
– liczba ich walencyjnych elektronów sparowanych jest dwukrotnie większa od liczby elektronów niesparowanych.
Zapisz skróconą (względem poprzedzającego gazu szlachetnego) klatkową konfigurację elektronową pierwiastka Y oraz określ liczbę jego elektronów niesparowanych. W konfiguracji klatkowej poszczególnym zbiorom orbitali przypisz podpowłokę do której należą uwzględniając wartość głównej liczby kwantowej. Skrócona konfiguracja klatkowa: Liczba elektronów niesparowanych: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie liczb orbitali opisujących elektrony dwóch różnych pierwiastków chemicznych
O dwóch pierwiastkach chemicznych X i Y wiadomo, że w stanie podstawowym:
– elektronom walencyjnym ich izotopów przypisuje się wartość głównej liczby kwantowej równą cztery,
– atomy pierwiastka X mają dwukrotnie mniej elektronów walencyjnych, niż atomy pierwiastka Y,
– liczba ich walencyjnych elektronów sparowanych jest dwukrotnie większa od liczby elektronów niesparowanych.
Określ liczby orbitali opisujących elektrony każdego z pierwiastków X oraz Y. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie wartości pH wodnego roztworu po zmieszaniu roztworu mocnego kwasu i mocnej zasady
Kwas siarkowy(VI) ulega dwuetapowej dysocjacji elektrolitycznej:
H2SO4 + H2O → HSO4– + H3O+ Ka1 = 103
HSO4– + H2O ⇄ SO4²– + H3O+ Ka2 = 1,02·10–2
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013 oraz K.-H. Lautenschläger i inni, Nowoczesne kompendium chemii, Warszawa 2018.
Do 160 cm3 0,1-molowego roztworu wodorotlenku potasu wprowadzono 40 cm3 roztworu kwasu siarkowego(VI) o stężeniu 0,4 mol∙dm–3.
Oblicz wartość pH uzyskanego roztworu. Wynik podaj z dokładnością do dwóch cyfr znaczących. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie nazw oraz liczb elektronów niesparowanych dwóch pierwiastków chemicznych na podstawie rozmieszczenia elektronów
W stanie podstawowym elektrony pierwiastków X oraz Y rozmieszczone są na czterech powłokach elektronowych, przy czym ich elektrony walencyjne znajdują się na jednej powłoce elektronowej. Pierwiastek X tworzy wodorek typu XH4, natomiast pierwiastek Y typu H2Y.
Podaj nazwy (lub symbole chemiczne) pierwiastków X oraz Y, a następnie określ w stanie podstawowym liczbę ich elektronów niesparowanych. Uzupełnij tabelę. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone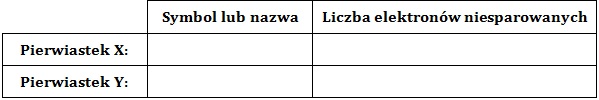
Ocena poprawności zdań na temat dwóch pierwiastków chemicznych określonych na podstawie rozmieszczenia elektronów
W stanie podstawowym elektrony pierwiastków X oraz Y rozmieszczone są na czterech powłokach elektronowych, przy czym ich elektrony walencyjne znajdują się na jednej powłoce elektronowej. Pierwiastek X tworzy wodorek typu XH4, natomiast pierwiastek Y typu H2Y.
Oceń poprawność poniższych zdań wpisując literę „P” (prawda) lub literę „F” (fałsz). 1. Długość promienia atomu pierwiastka X jest większa, niż długość promienia atomu pierwiastka Y. 2. Pierwiastek Y ma większą wartość pierwszej energii jonizacji, zatem trudniej przechodzi w postać anionu, niż pierwiastek X. 3. Tlenki pierwiastków X oraz Y, w których pierwiastkom tym przypisuje się ich najwyższy stopień utlenienia mają charakter zasadowy. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Rysowanie wzorów elektronowych wodorków dwóch pierwiastków chemicznych określonych na podstawie rozmieszczenia elektronów
W stanie podstawowym elektrony w atomach pierwiastków X oraz Y rozmieszczone są na czterech powłokach elektronowych, przy czym ich elektrony walencyjne znajdują się na jednej powłoce elektronowej. Pierwiastek X tworzy wodorek typu XH4, natomiast pierwiastek Y typu H2Y.
Narysuj kreskowe wzory elektronowe cząsteczek związków XH4 oraz H2Y z uwzględnieniem ich geometrii oraz symboli pierwiastków X i Y. Uzupełnij tabelę. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wybór poprawnych określeń na temat cząsteczek wodorków dwóch pierwiastków chemicznych określonych na podstawie rozmieszczenia elektronów
W stanie podstawowym elektrony w atomach pierwiastków X oraz Y rozmieszczone są na czterech powłokach elektronowych, przy czym ich elektrony walencyjne znajdują się na jednej powłoce elektronowej. Pierwiastek X tworzy wodorek typu XH4, natomiast pierwiastek Y typu H2Y.
Podkreśl wyrażenia w nawiasach tak, aby powstały zdania prawdziwe. Cząsteczki związku chemicznego XH4 mają kształt (kwadratu/tetraedru/trójkątny), natomiast cząsteczki związku H2Y mają budowę (liniową/tetraedryczną/kątową). Na podstawie analizy budowy przestrzennej cząsteczek wymienionych związków chemicznych można wnioskować, że moment dipolowy cząsteczki XH4 ma wartość (równą zeru/większą od zera), gdy jednocześnie cząsteczki H2Y (są/nie są) dipolami elektrycznymi. W konsekwencji, pomiędzy cząsteczkami (XH4/H2Y) obserwuje się oddziaływania typu dipol-dipol, zatem zbudowany z nich związek chemiczny ma temperaturę wrzenia (wyższą/niższą), niż związek zbudowany z cząsteczek o wzorze (XH4/H2Y). © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Opis obserwacji towarzyszących przeprowadzonemu doświadczeniu z udziałem mannozy, fruktozy oraz kleiku skrobiowego. Podręcznik 9.8 zad. 4
W trzech nieoznakowanych probówkach znajdowały się rozcieńczone roztwory: mannozy, fruktozy oraz kleiku skrobiowego. W celu ich identyfikacji, do każdego z wymienionych naczyń wprowadzono płyn Lugola, a następnie wodorowęglan sodu i energicznie wstrząśnięto ich zawartością. W jednej z probówek praktycznie natychmiast zaobserwowano zmianę barwy roztworu. W drugiej dopiero po ogrzaniu, a w trzeciej wcale.
Jakie obserwacje zanotowano po ogrzaniu zawartości drugiej z probówek? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczenia dotyczące wykorzystania wydzielonej na sposób ciepła energii do przeprowadzenia innej reakcji chemicznej
W tabeli poniżej zebrano dane na temat trzech niezależnych od siebie procesów chemicznych, podczas których biegną po dwie reakcje chemiczne.

Na podstawie: I. P. Muchlenow i inni, Ogólna technologia chemiczna, Warszawa 1974.
Efekt cieplny endotermicznej reakcji rozkładu jednego mola węglanu wapnia wynosi 178 kJ.
Przy założeniu 60% wydajności reakcji pierwszej oraz 90% wydajności drugiej reakcji w procesie nr 3, oblicz masę węglanu wapnia, jaka mogłaby zostać rozłożona wykorzystując wydzielone w procesie nr 3 ciepło, jeśli dysponujemy 34 g amoniaku. Przyjmij, że nie ma strat energii wynikających z jej wymiany z otoczeniem. Wynik obliczeń podaj z dokładnością do cyfry jedności. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie wydajności reakcji redukcji magnetytu prowadzącej do powstania żelaza (wydajność reakcji)
W pewnych warunkach reakcja redukcji magnetytu wodorem przebiega zgodnie z równaniem stechiometrycznym:
Fe3O4 + 4H2 → 3Fe + 4H2O
Próbkę magnetytu o masie 34,8 g poddano redukcji stosując nadmiar wodoru. Po zakończeniu reakcji chemicznej powstałe żelazo ważyło 18,9 g.
Oblicz jej procentową wydajność. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie masy magnetytu niezbędnej do uzyskania określonej objętości wody przy danej wydajności reakcji (wydajność reakcji)
W pewnych warunkach reakcja redukcji magnetytu wodorem przebiega zgodnie z równaniem stechiometrycznym:
Fe3O4 + 4H2 → 3Fe + 4H2O
W wyniku redukcji wodorem pewnej masy magnetytu, według opisanego równania reakcji chemicznej powstało 4,32 cm3 wody destylowanej.
Oblicz, jaka masa magnetytu została odważona, jeśli reakcja przebiegła z 80% wydajnością, a pomiaru objętości wody dokonano w temperaturze 277 K pod ciśnieniem normalnym? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie wydajności reakcji cynku z kwasem solnym (wydajność reakcji)
Roztworzono 3,25 g cynku w kwasie solnym, a powstały produkt gazowy zajął objętość w warunkach normalnych równą 1064 cm3.
Oblicz procentową wydajność opisanego procesu. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie masy ołowiu, gdy znana jest wydajność reakcji oraz ilość substratu
Przeprowadzono redukcję dwóch moli tlenku ołowiu(II) zgodnie z równaniem:
PbO + C → CO + Pb
Oblicz masę powstałego metalu, jeśli wydajność opisanego procesu wyniosła 85%. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zapis schematu ogniwa cynkowo-ołowiowego oraz obliczanie wartości jego SEM w stanie standardowym
Zbudowano ogniwo chemiczne z wykorzystaniem dwóch półogniw. W pierwszym z nich blaszka cynkowa zanurzona została w roztworze ZnSO4, a w drugim blaszka ołowiana w roztworze Pb(NO3)2.
Uzupełnij poniższy schemat ogniwa według tzw. konwencji sztokholmskiej, a następnie oblicz wartość siły elektromotorycznej tego ogniwa w stanie standardowym. anoda (–) || (+) katoda SEM: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone

