Obliczanie masy powstałego żelaza na podstawie masy produktu uzyskanego we współbieżnym procesie redukcji magnetytu
W pewnych warunkach reakcja redukcji magnetytu wodorem przebiega zgodnie z równaniem stechiometrycznym:
Fe3O4 + 4H2 → 3Fe + 4H2O
Podczas redukcji tlenku Fe3O4 wodorem może również przebiegać równolegle proces, którego produktem zamiast żelaza jest inny tlenek tego metalu (FeO) oraz woda. W wyniku redukcji 11,6 g magnetytu nadmiarem wodoru powstało 4,32 g tlenku żelaza(II).
Wiedząc, że w opisanych warunkach powstały tlenek żelaza(II) nie ulega dalszej redukcji, oblicz, jaką masę metalicznego żelaza uzyskano w tym doświadczeniu? Wynik podaj z dokładnością do drugiego miejsca po przecinku. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie symbolu pierwiastka chemicznego oraz konfiguracji elektronowej na podstawie opisu jego elektronów walencyjnych
W stanie podstawowym w atomach pewnego pierwiastka X elektrony walencyjne opisane orbitalami 3d stanowią dokładnie 60% jego wszystkich elektronów walencyjnych.
Podaj symbol pierwiastka X oraz jego pełną konfigurację elektronową. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie nazw drobin będących składowymi sieci krystalicznej związku chemicznego oraz określanie odczynu roztworu
Poniższy schemat przedstawia cykl kilku przemian chemicznych z udziałem różnych związków organicznych A÷E. Wiadomo, że podczas przemiany, której produktem jest związek chemiczny C powstaje brunatny osad, natomiast w wodnym roztworze związku chemicznego D fenoloftaleina barwi się na kolor malinowy.
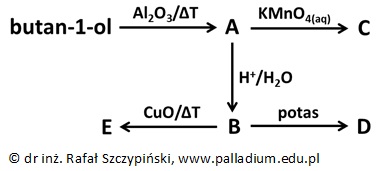
Podaj nazwy drobin, jakie występują w kryształach bezwodnego związku chemicznego D i zapisz w formie jonowej skróconej równanie reakcji chemicznej, jaka odpowiada za malinową barwę jego wodnego roztworu z dodatkiem fenoloftaleiny. Podaj nazwę opisanego procesu. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wypieranie metalu z roztworu soli za pomocą innego metalu, skład procentowy blaszki
W roztworze azotanu(V) bizmutu(III) o objętości równej 200 cm3 zanurzono płytkę niklową o masie 29,5 g. Po całkowitym usunięciu jonów Bi3+ z roztworu stwierdzono, że masa płytki wynosi 32 g.
Określ w procentach masowych skład płytki po zakończeniu reakcji. Wyniki obliczeń podaj z dokładnością do pierwszego miejsca po przecinku. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Przeliczanie stężenia procentowego roztworu perhydrolu na stężenie molowe
W celu usunięcia pozostałości organicznych ze szkła laboratoryjnego stosuje się tzw. roztwór piranię (ang. piranha solution). Jest to mieszanina 96-procentowego roztworu kwasu siarkowego(VI) o gęstości 1,84 g/cm3 i perhydrolu, czyli 30-procentowego roztworu nadtlenku wodoru o gęstości 1,11 g/cm3. Oba składniki roztworu pirania miesza się w stosunku objętościowym (odpowiednio) 7:3, a produktem przebiegającej reakcji chemicznej jest kwas nadtlenosiarkowy (H2SO5) oraz woda.
Oblicz stężenie molowe 30-procentowego roztworu perhydrolu. Wynik podaj z dokładnością do dwóch cyfr znaczących. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie liczby atomów kobaltu osadzonych na blaszce (blaszki)
W wodnym roztworze chlorku kobaltu(II) zanurzono blaszkę wykonaną z manganu. Po zakończeniu reakcji chemicznej stwierdzono, że jej masa zmieniła się o 20 mg.
Oblicz, ile miligramów jonów manganu(II) pojawiło się w roztworze oraz ile atomów kobaltu osadziło się na blaszce? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie, jaki procent jonów został usunięty z roztworu (blaszki)
W 100 cm3 roztworu siarczanu(VI) miedzi(II) o stężeniu 0,5 mol∙dm–3 zanurzono płytkę niklową o masie równej 5 g. W układzie przebiegła reakcja chemiczna opisana równaniem:
Ni + Cu2+ → Ni2+ + Cu
Po jej zakończeniu płytkę przemyto wodą dejonizowaną, wysuszono i zważono. Stwierdzono, że jej masa wynosi 5,125 g.
Oblicz, jaki procent jonów miedzi(II) został usunięty z roztworu? Przyjmij, że masa mola atomów niklu wynosi 59 g, a miedzi 64 g. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie o ile procent zmienia się masa blaszki po usunięciu wszystkich jonów z roztworu (blaszki)
W 100 cm3 roztworu siarczanu(VI) miedzi(II) o stężeniu 0,5 mol∙dm–3 zanurzono płytkę niklową o masie równej 5 g. W układzie przebiegła reakcja chemiczna opisana równaniem:
Ni + Cu2+ → Ni2+ + Cu
Po jej zakończeniu płytkę przemyto wodą dejonizowaną, wysuszono i zważono. Stwierdzono, że jej masa wynosi 5,125 g.
Oblicz, o ile procent zwiększyłaby się masa wyjściowej blaszki, gdyby z roztworu usunięte zostały wszystkie jony Cu2+? Przyjmij, że masa mola atomów niklu wynosi 59 g, a miedzi 64 g. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie symbolu pierwiastka chemicznego na podstawie opisu rozmieszczenia jego elektronów
W atomie pewnego pierwiastka chemicznego X, który w układzie okresowym leży przed pierwiastkiem Y o skróconej konfiguracji elektronowej [Ar] 3d104s24p6, w stanie podstawowym liczba sparowanych elektronów walencyjnych opisanych orbitalem s równa jest liczbie jego walencyjnych elektronów niesparowanych opisanych orbitalami d. Po utworzeniu drobiny X2+, liczba jej elektronów niesparowanych jest trzykrotnie mniejsza od liczby jej elektronów sparowanych tej samej podpowłoki elektronowej.
Opisanym pierwiastkiem X jest (podaj symbol lub nazwę) ……………………………, a liczba elektronów znajdujących się w jonie X2+ każdego z izotopów pierwiastka X wynosi ……. . © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie wzoru jonu prostego na podstawie opisu rozmieszczenia jego elektronów
W atomie metalicznego pierwiastka o czterech powłokach elektronowych, w stanie podstawowym liczba walencyjnych elektronów sparowanych jest dziesięciokrotnie większa od liczby elektronów niesparowanych.
Podaj wzór oraz skróconą (względem poprzedzającego gazu szlachetnego) konfigurację elektronową dwudodatniego jonu tego pierwiastka. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone

