Określanie symbolu pierwiastka oraz jego skróconej konfiguracji elektronowej na podstawie opisu rozmieszczenia elektronów
Elektrony pewnego pierwiastka chemicznego X rozmieszczone są na pięciu powłokach elektronowych, przy czym:
– elektrony walencyjne zajmują wyłącznie jedną powłokę,
– sparowane elektrony walencyjne zajmują dwie podpowłoki i jest ich dwukrotnie więcej, niż walencyjnych elektronów niesparowanych.
Podaj symbol lub nazwę opisanego pierwiastka oraz jego skróconą (względem poprzedzającego gazu szlachetnego) konfigurację elektronową. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie wzoru sumarycznego tlenku na podstawie konfiguracji klatkowej elektronów walencyjnych pierwiastka
W stanie podstawowym elektrony walencyjne pewnego pierwiastka X opisuje następująca konfiguracja klatkowa:

Wiadomo, że przy najwyższym stopniu utlenienia pierwiastek ten tworzy gazowy tlenek o charakterze kwasowym.
Podaj wzór sumaryczny tlenku, w którym pierwiastkowi X przypisuje się jego najwyższy stopień utlenienia oraz wskaż rodzaj (typ) występującego w nim wiązania chemicznego (kowalencyjne, kowalencyjne spolaryzowane, jonowe). Rozwiązanie tego zadania dostępne jest nieodpłatnie pod poniższym linkiem: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie konfiguracji walencyjnej na podstawie opisu rozmieszczenia elektronów
O dwóch pierwiastkach X i Y wiadomo, że:
– ich elektrony walencyjne w stanie podstawowym zajmują tę samą powłokę elektronową, a liczba walencyjnych elektronów sparowanych jest dwukrotnie większa od liczby elektronów niesparowanych,
– drobiny Xa+ są izoelektronowe z atomami neonu, natomiast drobiny Yb– – z atomami argonu.
Podaj (przy użyciu symboli podpowłok) konfiguracje walencyjne pierwiastków X i Y. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Uzasadnienie odczynu roztworu uzyskanego w wyniku przebiegu reakcji chemicznej
W pięciu kolbach miarowych (250 cm3 każda) umieszczono 0,5-molowe, wodne roztwory następujących związków chemicznych:
1) NaOH 2) HCOOH 3) HCl 4) H2SO4 5) NH3
Napisz w formie jonowej skróconej równanie reakcji chemicznej, jaka odpowiada za odczyn wodnego roztworu uzyskanego w wyniku zmieszania równych objętości roztworów z kolb o numerach 3 i 5. Wskaż sprzężoną według teorii Brønsteda parę kwas-zasada, w podanym przez Ciebie równaniu reakcji. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie stężenia roztworu kwasu octowego na podstawie znajomości jego pH
Wodne roztwory kwasu etanowego są słabymi elektrolitami, przy czym stała równowagi reakcji dysocjacji tego kwasu ma wartość 1,8∙10–5.
Oblicz stężenie molowe roztworu kwasu etanowego o wartości pH równej 3. Wynik podaj z dokładnością do trzeciego miejsca po przecinku. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Porównanie własności dwóch pierwiastków chemicznych w odniesieniu do energii jonizacji
Elektrony pierwiastka X rozmieszczone są na trzech powłokach elektronowych. W stanie podstawowym, stosunek liczby jego walencyjnych elektronów sparowanych do liczby walencyjnych elektronów niesparowanych równy jest 6:1. Atomy pierwiastka Y mają o 36 dodatnich ładunków jądra atomowego więcej, niż atomy pierwiastka X.
Podkreśl wyrażenia w nawiasach tak, aby powstały zdania prawdziwe. Pierwiastki X oraz Y należą do bloku energetycznego (s/p/d). Wartość pierwszej energii jonizacji pierwiastka X jest (większa/mniejsza) od wartości pierwszej energii jonizacji pierwiastka Y, co pozwala sądzić, że pierwiastek Y ma (silniejsze/słabsze) właściwości utleniające od pierwiastka X. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie skróconej konfiguracji elektronowej oraz liczby niesparowanych elektronów na podstawie opisu rozmieszczenia elektronów
Elektrony pierwiastka X rozmieszczone są na trzech powłokach elektronowych. W stanie podstawowym, stosunek liczby jego walencyjnych elektronów sparowanych do liczby walencyjnych elektronów niesparowanych równy jest 6:1. Atomy pierwiastka Y mają o 36 dodatnich ładunków jądra atomowego więcej, niż atomy pierwiastka X.
Napisz nazwę oraz skróconą konfigurację elektronową pierwiastka Y, a następnie podaj liczbę jego elektronów niesparowanych. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie symbolu pierwiastka chemicznego na podstawie stosunku liczb elektronów walencyjnych
Elektrony pierwiastka X rozmieszczone są na trzech powłokach elektronowych. W stanie podstawowym, stosunek liczby jego walencyjnych elektronów sparowanych do liczby walencyjnych elektronów niesparowanych równy jest 6:1. Atomy pierwiastka Y mają o 36 dodatnich ładunków jądra atomowego więcej, niż atomy pierwiastka X.
Podaj nazwę oraz konfigurację elektronową pierwiastka X i podkreśl ten jej fragment, który opisuje elektrony walencyjne. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Przypisywanie krzywej zależności pH od stężenia kwasu odpowiedniemu roztworowi
Zmierzono wartości pH wodnych roztworów trzech kwasów oznaczonych kolejnymi literami alfabetu (A, B, C). Pomiarów dokonano w temperaturze 25 oC, w zakresie stężeń 10–6÷10–1 mol·dm–3, a wyniki eksperymentu przedstawiono w postaci graficznej.
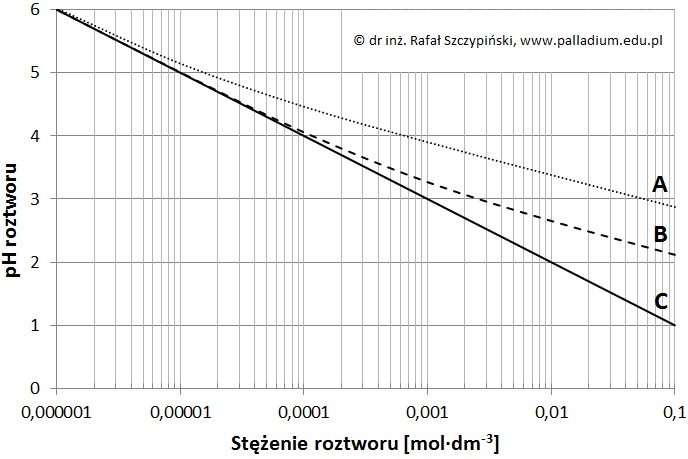
Spośród podanych niżej kwasów wybierz i przyporządkuj literom A, B i C opisującym krzywe na wykresie wzory trzech, których wodne roztwory poddano pomiarom wartości pH: C6H5OH, HBr, HF, CH3COOH. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie stężenia molowego kwasu na podstawie odczytanej z wykresu wartości pH roztworu
Zmierzono wartości pH wodnych roztworów trzech kwasów oznaczonych kolejnymi literami alfabetu (A, B, C). Pomiarów dokonano w temperaturze 25 oC, w zakresie stężeń 10–6÷10–1 mol·dm–3, a wyniki eksperymentu przedstawiono w postaci graficznej.

Wartość pH pewnego roztworu kwasu mlekowego jest identyczna z wartością pH 0,0006-molowego roztworu najsłabszego z kwasów, których roztwory poddano pomiarom.
Podaj oznaczenie literowe (A, B lub C) kwasu o którym jest mowa, a następnie oblicz stężenie molowe roztworu kwasu mlekowego, któremu odpowiada odczytana przez Ciebie wartość pH. Wartość Ka kwasu mlekowego w temperaturze 25 oC wynosi 1,35·10–4. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone

