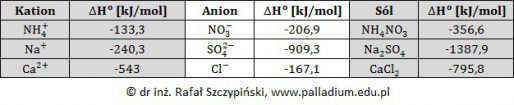
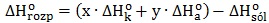Obliczanie entalpii procesu całkowitego uwodornienia buta-1,3-dienu
W tabeli poniżej zebrano dane na temat trzech niezależnych od siebie procesów chemicznych, podczas których biegną po dwie reakcje chemiczne.

Na podstawie: I. P. Muchlenow i inni, Ogólna technologia chemiczna, Warszawa 1974.
Na podstawie danych zawartych w tabeli dotyczących procesu nr 2 określ wartość entalpii reakcji całkowitego uwodornienia jednego mola buta-1,3-dienu. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie entalpii wieloetapowego procesu podczas otrzymywania tlenku siarki(VI)
W tabeli poniżej zebrano dane na temat trzech niezależnych od siebie procesów chemicznych, podczas których biegną po dwie reakcje chemiczne.

Na podstawie: I. P. Muchlenow i inni, Ogólna technologia chemiczna, Warszawa 1974.
W celu otrzymania tlenku siarki(VI) w procesie nr 1, spaleniu poddano 6,4 g siarki.
Zakładając 100% wydajność tej reakcji oraz 80% wydajność reakcji utleniania tlenku siarki(IV) określ, jaki będzie sumaryczny efekt cieplny (entalpia) procesu? Wynik obliczeń podaj z dokładnością do cyfry jedności. Rozwiązanie tego zadania dostępne jest nieodpłatnie pod poniższym linkiem: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Ustalanie stosunku molowego saletry i mocznika w nawozie azotowym
Nawozy sztuczne mogą stanowić mieszaniny o różnym składzie jakościowym oraz ilościowym. W przypadku nawozów azotowych często mamy do czynienia z mieszaninami soli kwasu azotowego(V) oraz mocznika – związku chemicznego o wzorze (NH2)2CO.
Ustal, w jakim stosunku molowym należy zmieszać saletrę amonową (NH4NO3) z mocznikiem, aby uzyskany nawóz zawierał 42% masowych azotu. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Ustalanie procentowego składu wagowego nawozu zawierającego mączkę dolomitową
Pewien nawóz sztuczny jest mieszaniną azotanu(V) amonu i siarczanu(VI) amonu z dodatkiem mączki dolomitowej. W nawozie tym siarka stanowi 6% masy, a azot w formie amonowej 17%.
Wiedząc, że mączka dolomitowa jest równomolową mieszaniną węglanów – wapnia oraz magnezu, oblicz zawartość procentową czterech opisanych składników nawozu. Wyniki obliczeń podaj z dokładnością do drugiego miejsca po przecinku. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie mas składników jakie należy odważyć, w celu przygotowania określonej masy nawozu o nazwie saletrzak
Saletrzaki to nawozy sztuczne, które jako główne składniki zawierają związki chemiczne zwane saletrami. Ponadto mogą zawierać inne substancje chemiczne, np. tlenek magnezu. Przykładem saletrzaka jest mieszanina soli KNO3 oraz NH4NO3 z tlenkiem magnezu, w której azot w formie amonowej stanowi 7,73% masy azotowych składników nawozu, a magnez w postaci tlenku 2,4% masy nawozu.
Oblicz, jakie ilości składników tego nawozu należy odważyć, w celu uzyskania 5 kg opisanego preparatu. Wyniki podaj w gramach, z dokładnością do cyfry jedności. Rozwiązanie tego zadania dostępne jest nieodpłatnie pod poniższym linkiem: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie efektu cieplnego reakcji chemicznej z uzasadnieniem
W jednym z etapów produkcji kwasu azotowego(V) ustala się równowaga opisana równaniem:
2NO2(g) ⇄ N2O4(g)
W miarę obniżania temperatury ilość powstającego N2O4 stopniowo wzrasta i dochodzi do 80% objętościowych w temperaturze 300 K.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
Określ, czy opisana reakcja chemiczna jest procesem egzo- czy endotermicznym? Uzasadnij swoje stanowisko. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie ilości roztworu metanolu uzyskanego w wyniku przebiegu reakcji chemicznej (wydajność reakcji)
Na skalę techniczną metanol otrzymuje się w procesie, podczas przebiegu którego w układzie ustala się równowaga dynamiczna opisana równaniem:
CO(g) + 2H2(g) ⇄ CH3OH(g) ΔH = -128,2 kJ/mol
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
Zakład przemysłowy dysponuje mieszaniną tlenku węgla(II) z wodorem, której masa wynosi 2,9 tony. W mieszaninie tej na każdą cząsteczkę wodoru przypadają dwie cząsteczki tlenku węgla(II).
Oblicz, jaką ilość 80%, wodnego roztworu metanolu można wyprodukować, jeśli przyjmiemy, że synteza tego alkoholu przebiega z wydajnością reakcji równą 80%? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie efektu cieplnego reakcji chemicznej oraz przyczyny konieczności ogrzania układu
W temperaturze bliskiej 333 K tlenek chloru(IV) ulega gwałtownej reakcji rozkładu:
2ClO2 → Cl2 + 2O2 ΔHo = -387 kJ
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
Określ, czy rozkład ClO2 jest procesem egzo- czy endotermicznym oraz uzasadnij konieczność ogrzania układu reakcyjnego, w celu zainicjowania biegu opisanej reakcji. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie wartości entalpii tworzenia tlenku chloru(IV)
W temperaturze bliskiej 333 K tlenek chloru(IV) ulega gwałtownej reakcji rozkładu:
2ClO2 → Cl2 + 2O2 ΔHo = -387 kJ
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
Na podstawie efektu cieplnego podanej reakcji chemicznej określ wartość entalpii tworzenia tlenku chloru(IV). © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Ocena, czy reakcja kwasu solnego z roztworem zasady potasowej jest procesem endotermicznym czy egzotermicznym
Wraz ze wzrostem temperatury wzrasta wartość iloczynu jonowego wody (Kw), wielkości opisującej równowagę reakcji autodysocjacji wody:
2H2O ⇄ H3O+ + OH–
Napisz, czy w wyniku reakcji przebiegającej podczas wprowadzania wodnego roztworu kwasu solnego do wodnego roztworu wodorotlenku potasu następuje emisja energii cieplnej z układu do otoczenia. Uzasadnij odpowiedź. Odpowiedź: Uzasadnienie: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie stosunku molowego oraz wagowego substratów w reakcji syntezy bromku żelaza(III)
Bromek żelaza(III) jest związkiem chemicznym, który można otrzymać w wyniku reakcji syntezy. Opisaną przemianę ilustruje równanie:
2Fe + 3Br2 → 2FeBr3
Określ molowy oraz wagowy stosunek stechiometryczny, w jakim reagują substraty podczas przebiegu opisanej reakcji chemicznej. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie masy bromku żelaza(III) powstałego w wyniku reakcji żelaza ze stechiometryczną ilością bromu
Bromek żelaza(III) jest związkiem chemicznym, który można otrzymać w wyniku reakcji syntezy. Opisaną przemianę ilustruje równanie:
2Fe + 3Br2 → 2FeBr3
Oblicz masę bromku żelaza(III) powstałego po zmieszaniu 4,2 g żelaza ze stechiometryczną ilością bromu i zainicjowaniu reakcji chemicznej. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone