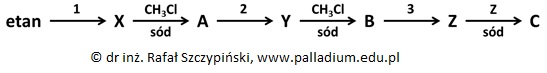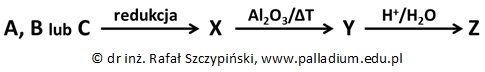Zapis równań reakcji chemicznych na podstawie przeprowadzonego eksperymentu z udziałem alkoholi
Pewne nasycone, izomeryczne alkohole łańcuchowe reagują z wapniem w stosunku wagowym równym (odpowiednio) 3:1, natomiast z sodem w stosunku molowym 1:1.
W wyniku dwuetapowego procesu, pierwszorzędowy spośród opisanych w informacji wstępnej alkoholi można przekształcić w jego izomer o wyższej rzędowości. W jednym z etapów stosuje się wówczas między innymi rozcieńczony roztwór kwasu siarkowego(VI).
Napisz równania reakcji chemicznych przebiegających podczas każdego z etapów opisanego procesu. W tym celu zastosuj odpowiednie warunki ich prowadzenia oraz wzory półstrukturalne (grupowe) biorących w nich udział związków organicznych. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie wzoru rzeczywistego związku organicznego na podstawie przeprowadzonego doświadczenia
Dane są trzy izomeryczne związki chemiczne A, B i C zawierające grupę karbonylową, a ich wodne roztwory mają odczyn obojętny. Próbkę każdego z nich o masie równej 7,2 g spalono w nadmiarze tlenu. Po skropleniu uzyskanej pary wodnej, pozostałą mieszaninę gazów o objętości 11,02 dm3 przepuszczono przez płuczkę zawierającą nadmiar wodnego roztworu wodorotlenku potasu. Objętość gazu opuszczającego płuczkę wyniosła 2,06 dm3, a masa skroplonej pary wodnej była taka sama, jak masa próbki poddanej spaleniu. Objętości wszystkich gazów odmierzono w warunkach normalnych.
Określ, prowadząc stosowne obliczenia wzór rzeczywisty spalonego związku organicznego, jeśli wiadomo, że jest taki sam jak jego wzór empiryczny. Rozwiązanie tego zadania dostępne jest nieodpłatnie pod poniższym linkiem: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zapis równania reakcji chemicznej z udziałem kwasu bromowodorowego oraz towarzyszących jej objawów
W kolbie wypełnionej argonem umieszczono blaszkę wykonaną z chromu. Do naczynia wprowadzono następnie nadmiar odpowietrzonego, 10% roztworu kwasu siarkowego(VI). Po zakończeniu przebiegu reakcji chemicznej uzyskany roztwór rozlano do dwóch zlewek i zmontowano układ zilustrowany rysunkiem:
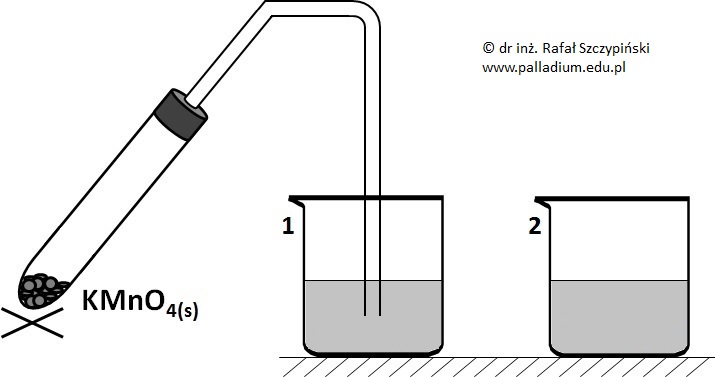
Po zakończeniu przebiegającej w probówce reakcji chemicznej postanowiono odzyskać z mieszaniny poreakcyjnej jeden z jej produktów. W tym celu zawartość probówki przepłukano wodą destylowaną i przesączono. Związek chemiczny znajdujący się na sączku dokładnie przemyto i wysuszono, a następnie umieszczono w kolbie zawierającej roztwór kwasu bromowodorowego.
Napisz w formie jonowej skróconej równanie przebiegającej w kolbie reakcji chemicznej oraz wymień towarzyszące jej dwa objawy. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wyjaśnienie przyczyny różnego zachowania się dwóch dioli wobec świeżo strąconego osadu wodorotlenku miedzi(II)
Pewne nasycone, izomeryczne alkohole łańcuchowe reagują z wapniem w stosunku wagowym równym (odpowiednio) 3:1, natomiast z sodem w stosunku molowym 1:1.
Istnieją pewne diole, których szkielety węglowe są takie same, jak opisanych izomerów reagujących z wapniem. Pierwszy z nich roztwarza świeżo strącony osad wodorotlenku miedzi(II) tworząc z nim barwny kompleks, a pozostałe nie.
Podaj nazwy systematyczne opisanych dioli oraz wyjaśnij opisane różnice w zachowaniu tych związków chemicznych wobec świeżo strąconego osadu wodorotlenku miedzi(II). © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zapis obserwacji na podstawie przeprowadzonego doświadczenia z udziałem chromu i roztworu kwasu wraz z uzasadnieniem
W kolbie wypełnionej argonem umieszczono blaszkę wykonaną z chromu. Do naczynia wprowadzono następnie nadmiar odpowietrzonego, 10% roztworu kwasu siarkowego(VI). Po zakończeniu przebiegu reakcji chemicznej uzyskany roztwór rozlano do dwóch zlewek i zmontowano układ zilustrowany rysunkiem:

Zlewkę nr 2 z zawartym w niej roztworem pozostawiono otwartą przez kilkanaście godzin. Nazajutrz stwierdzono, że w górnej części roztworu pojawiło się identyczne jak w zlewce nr 1 zabarwienie.
Napisz, jaką barwę przyjął roztwór oraz wyjaśnij, dlaczego zmiana nie była widoczna w całej jego objętości? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Rysowanie wzoru stereochemicznego określonego alkoholu (izomeria optyczna)
Pewne nasycone, izomeryczne alkohole łańcuchowe reagują z wapniem w stosunku wagowym równym (odpowiednio) 3:1, natomiast z sodem w stosunku molowym 1:1.
Istnieją pewne diole, których szkielety węglowe są takie same, jak opisanych izomerów reagujących z wapniem. Jeden z opisanych dioli wykazuje czynność optyczną.
Uzupełnij poniższy schemat tak, aby przedstawiał parę enancjomerów tego diolu. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Ocena, czy masa manganowej blaszki uległa zwiększeniu, czy zmniejszeniu (blaszki)
W wodnym roztworze chlorku kobaltu(II) zanurzono blaszkę wykonaną z manganu. Po zakończeniu reakcji chemicznej stwierdzono, że jej masa uległa zmianie.
Oceń, czy masa blaszki uległa zwiększeniu, czy zmniejszeniu? Odpowiedź uzasadnij odpowiednimi obliczeniami. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie wzoru półstrukturalnego oraz nazwy związku organicznego (izomeria optyczna)
Pewien występujący w postaci enancjomerów nasycony, alifatyczny keton łańcuchowy A poddano redukcji wodorem. Produkt B tej reakcji odwodniono w obecności tlenku glinu i uzyskano równomolową mieszaninę alkenów C i D. Związek C występuje jako para izomerów geometrycznych, natomiast związek D – enancjomerów. Centrum chiralności związku D jest ten sam atom węgla, co w wyjściowym ketonie A. Głównymi produktami addycji wody do związków chemicznych C i D są alkohole o najwyższej rzędowości.
Wiedząc, że produktem addycji wodoru do alkenów jest 2,4-dimetyloheksan, podaj wzór półstrukturalny oraz nazwę systematyczną związku chemicznego A. Zapisz numer lokantu, którym opisany jest asymetryczny atom węgla w jego cząsteczce. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Procent wagowy jonów węglanowych w musującej tabletce suplementującej magnez
Niedobory jonów Mg2+ powstałe w wyniku ciężkiego wysiłku fizycznego mogą być uzupełniane w wyniku ich suplementacji za pomocą musujących tabletek zawierających węglan magnezu, kwas cytrynowy, kwas jabłkowy oraz inne substancje pomocnicze.
Wiedząc, że opakowanie zawiera 20 tabletek, a ich sumaryczna masa wynosi 80 g, oblicz, jaki procent wagowy w musującej tabletce stanowią jony węglanowe pochodzące z węglanu magnezu, jeśli jony Mg2+ ważą 200 mg w przeliczeniu na jedną tabletkę? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie liczby wiązań sigma oraz typu hybrydyzacji orbitali walencyjnych atomu węgla w karbokationie
W pierwszym etapie reakcji alkenu z wodą w obecności rozcieńczonego kwasu siarkowego(VI) powstaje karbokation. Ogólny schemat budowy takiej drobiny przedstawia rysunek:
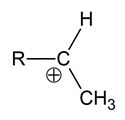
Określ liczbę wiązań σ jakie tworzy atom węgla na którym zlokalizowany jest ładunek dodatni oraz typ hybrydyzacji (sp, sp2, sp3) jego orbitali walencyjnych. Liczba wiązań σ: Typ hybrydyzacji: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone