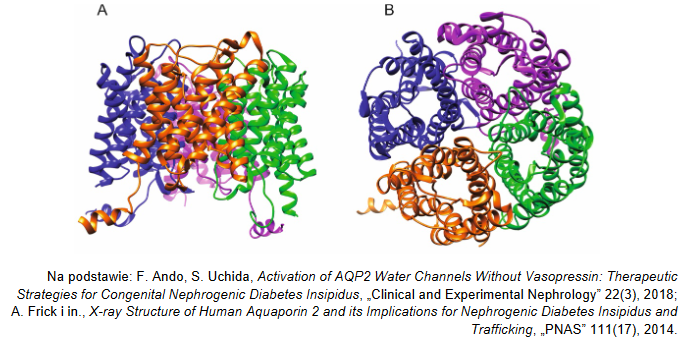
Zapis symbolu nuklidu. Zadanie 1.1. Arkusz CKE chemia czerwiec 2024 rozszerzony formuła 2015 (1 punkt)
Dwa pierwiastki E i X tworzą jony E+ i X– o takiej samej konfiguracji elektronowej 1s22s22p63s23p6 (stan podstawowy). W atomie jednego z trwałych izotopów pierwiastka E liczba nukleonów jest o 20 większa od liczby protonów.
Uzupełnij poniższy schemat. Wpisz w odpowiednie pola symbol pierwiastka E, jego liczbę atomową oraz liczbę masową opisanego izotopu.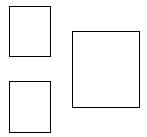
Zapis liczby atomowej, symbolu pierwiastka oraz liczby masowej izotopu. Zadanie 1.1. Arkusz CKE chemia czerwiec 2024 rozszerzony (1 punkt)
Liczba atomowa pierwiastka X jest dwa razy większa od liczby atomowej rutenu (Ru). Liczba neutronów w jądrze pewnego izotopu pierwiastka X jest równa liczbie masowej izotopu baru, w którego jądrze znajduje się 81 neutronów. Z tego izotopu pierwiastka X w ciągu rozpadów α i β– powstaje nietrwały izotop ołowiu zawierający w jądrze 127 neutronów. Ten izotop ulega następnie przemianie w trwały izotop 209Bi.
Uzupełnij tabelę. Wpisz wartość liczby atomowej i symbol pierwiastka X oraz wartość liczby masowej opisanego izotopu pierwiastka X.
Zapis walencyjnej konfiguracji elektronowej atomu. Zadanie 1.2. Arkusz CKE chemia czerwiec 2024 rozszerzony formuła 2015 (1 punkt)
Dwa pierwiastki E i X tworzą jony E+ i X– o takiej samej konfiguracji elektronowej 1s22s22p63s23p6 (stan podstawowy). W atomie jednego z trwałych izotopów pierwiastka E liczba nukleonów jest o 20 większa od liczby protonów.
Napisz fragment konfiguracji elektronowej atomu X w stanie podstawowym opisujący rozmieszczenie elektronów walencyjnych na orbitalach. Zastosuj graficzny (klatkowy) zapis konfiguracji elektronowej. W zapisie uwzględnij numer powłoki i symbole podpowłok.
Wskazanie liczby przemian alfa oraz beta. Zadanie 1.2. Arkusz CKE chemia czerwiec 2024 rozszerzony (1 punkt)
Liczba atomowa pierwiastka X jest dwa razy większa od liczby atomowej rutenu (Ru). Liczba neutronów w jądrze pewnego izotopu pierwiastka X jest równa liczbie masowej izotopu baru, w którego jądrze znajduje się 81 neutronów. Z tego izotopu pierwiastka X w ciągu rozpadów α i β– powstaje nietrwały izotop ołowiu zawierający w jądrze 127 neutronów. Ten izotop ulega następnie przemianie w trwały izotop 209Bi.
Uzupełnij tabelę. Wpisz liczbę przemian α i β– zachodzących podczas powstawania izotopu ołowiu z opisanego izotopu pierwiastka X.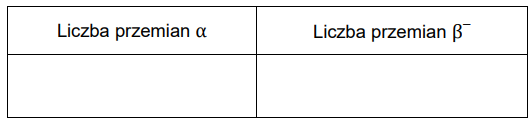
Zapis wzoru sumarycznego tlenku oraz określenie charakteru chemicznego. Zadanie 1.3. Arkusz CKE chemia czerwiec 2024 rozszerzony formuła 2015 (1 punkt)
Dwa pierwiastki E i X tworzą jony E+ i X– o takiej samej konfiguracji elektronowej 1s22s22p63s23p6 (stan podstawowy). W atomie jednego z trwałych izotopów pierwiastka E liczba nukleonów jest o 20 większa od liczby protonów.
Pierwiastek E przyjmuje w związkach chemicznych jeden stopień utlenienia, a pierwiastek X tworzy związki, w których występuje na różnych stopniach utlenienia.
Określ charakter chemiczny (kwasowy, zasadowy, amfoteryczny, obojętny) tlenku pierwiastka E. Napisz wzór sumaryczny tlenku pierwiastka X, w którym ten pierwiastek przyjmuje najwyższy stopień utlenienia. Charakter chemiczny tlenku pierwiastka E: Wzór sumaryczny tlenku pierwiastka X na najwyższym stopniu utlenienia:
Zapis równania przemiany jądrowej. Zadanie 1.3. Arkusz CKE chemia czerwiec 2024 rozszerzony (1 punkt)
Liczba atomowa pierwiastka X jest dwa razy większa od liczby atomowej rutenu (Ru). Liczba neutronów w jądrze pewnego izotopu pierwiastka X jest równa liczbie masowej izotopu baru, w którego jądrze znajduje się 81 neutronów. Z tego izotopu pierwiastka X w ciągu rozpadów α i β– powstaje nietrwały izotop ołowiu zawierający w jądrze 127 neutronów. Ten izotop ulega następnie przemianie w trwały izotop 209Bi.
Napisz równanie – opisanej w informacji – przemiany izotopu ołowiu w izotop bizmutu. Uzupełnij wszystkie pola w poniższym schemacie.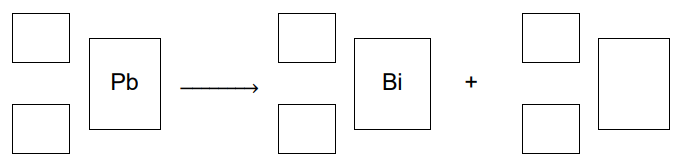
Zapis wzoru elektronowego monomeru chlorku galu(III). Zadanie 2.1. Arkusz CKE chemia czerwiec 2024 rozszerzony (1 punkt)
Gal tworzy trihalogenki, np. chlorek galu(III). W fazie stałej chlorek galu(III) występuje głównie w postaci dimerów, a w fazie gazowej – jako mieszanina dimerów i monomerów. Monomer chlorku galu(III) jest płaską cząsteczką, w której wszystkie atomy chloru są równocenne. Model dimeru przedstawiono na rysunku.
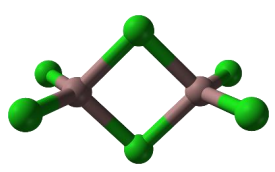
Na podstawie: CRC Handbook of Chemistry and Physics 97th Edition, CRC Press 2017.
Narysuj wzór elektronowy monomeru chlorku galu(III). Zaznacz kreskami wiążące i wolne pary elektronowe.
Rysowanie wzoru elektronowego chlorku galu(III). Zadanie 2.1. Arkusz CKE chemia czerwiec 2024 rozszerzony formuła 2015 (1 punkt)
Gal tworzy trihalogenki, np. chlorek galu(III). W fazie stałej chlorek galu(III) występuje głównie w postaci dimerów, a w fazie gazowej – jako mieszanina dimerów i monomerów. Monomer chlorku galu(III) jest płaską cząsteczką, w której wszystkie atomy chloru są równocenne. Model dimeru przedstawiono na rysunku.
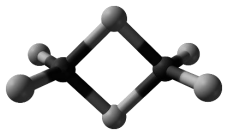
Na podstawie: CRC Handbook of Chemistry and Physics 97th Edition, CRC Press 2017.
Narysuj wzór elektronowy monomeru chlorku galu(III). Zaznacz kreskami wiążące i wolne pary elektronowe.
Zapis typów hybrydyzacji orbitali walencyjnych atomu galu. Zadanie 2.2. Arkusz CKE chemia czerwiec 2024 rozszerzony formuła 2015 (1 punkt)
Gal tworzy trihalogenki, np. chlorek galu(III). W fazie stałej chlorek galu(III) występuje głównie w postaci dimerów, a w fazie gazowej – jako mieszanina dimerów i monomerów. Monomer chlorku galu(III) jest płaską cząsteczką, w której wszystkie atomy chloru są równocenne. Model dimeru przedstawiono na rysunku.

Na podstawie: CRC Handbook of Chemistry and Physics 97th Edition, CRC Press 2017.
Uzupełnij tabelę. Napisz, jaki typ hybrydyzacji (sp, sp2 albo sp3) przypisuje się orbitalom walencyjnym atomu galu w monomerze oraz w dimerze chlorku galu(III).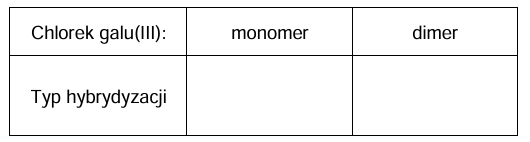
Określanie typu hybrydyzacji orbitali walencyjnych atomu galu. Zadanie 2.2. Arkusz CKE chemia czerwiec 2024 rozszerzony (1 punkt)
Gal tworzy trihalogenki, np. chlorek galu(III). W fazie stałej chlorek galu(III) występuje głównie w postaci dimerów, a w fazie gazowej – jako mieszanina dimerów i monomerów. Monomer chlorku galu(III) jest płaską cząsteczką, w której wszystkie atomy chloru są równocenne. Model dimeru przedstawiono na rysunku.

Na podstawie: CRC Handbook of Chemistry and Physics 97th Edition, CRC Press 2017.
Uzupełnij tabelę. Napisz, jaki typ hybrydyzacji (sp, sp2 albo sp3 ) przypisuje się orbitalom walencyjnym atomu galu w monomerze oraz w dimerze chlorku galu(III).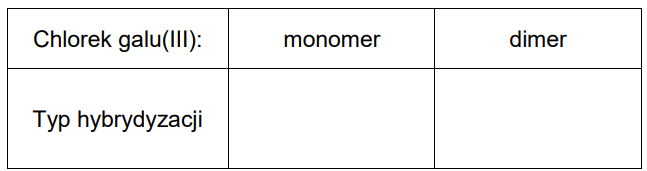
Wyjaśnienie przyczyny tworzenia się dimerów chlorku galu. Zadanie 2.3. Arkusz CKE chemia czerwiec 2024 rozszerzony formuła 2015 (1 punkt)
Gal tworzy trihalogenki, np. chlorek galu(III). W fazie stałej chlorek galu(III) występuje głównie w postaci dimerów, a w fazie gazowej – jako mieszanina dimerów i monomerów. Monomer chlorku galu(III) jest płaską cząsteczką, w której wszystkie atomy chloru są równocenne. Model dimeru przedstawiono na rysunku.

Na podstawie: CRC Handbook of Chemistry and Physics 97th Edition, CRC Press 2017.
Wyjaśnij, dlaczego monomery chlorku galu(III) mają zdolność łączenia się w dimery. Uwzględnij sposób powstawania wiązań, dzięki którym z monomeru chlorku galu(III) powstaje dimer.
Wyjaśnienie przyczyny możliwości łączenia się monomerów chlorku galu(III) w dimery. Zadanie 2.3. Arkusz CKE chemia czerwiec 2024 rozszerzony (1 punkt)
Gal tworzy trihalogenki, np. chlorek galu(III). W fazie stałej chlorek galu(III) występuje głównie w postaci dimerów, a w fazie gazowej – jako mieszanina dimerów i monomerów. Monomer chlorku galu(III) jest płaską cząsteczką, w której wszystkie atomy chloru są równocenne. Model dimeru przedstawiono na rysunku.

Na podstawie: CRC Handbook of Chemistry and Physics 97th Edition, CRC Press 2017.
Wyjaśnij, dlaczego monomery chlorku galu(III) mają zdolność łączenia się w dimery. Uwzględnij sposób powstawania wiązań, dzięki którym z monomeru chlorku galu(III) powstaje dimer.
Uzupełnienie schematu klatkowego konfiguracji elektronowej kationu tytanu(II). Zadanie 3.1. Arkusz CKE chemia czerwiec 2024 rozszerzony (1 punkt)
Tytan jest lekkim metalem odpornym na korozję. W zależności od stopnia utlenienia tytanu chlorki tego pierwiastka odznaczają się różnymi właściwościami fizycznymi. Wartości temperatury topnienia i temperatury wrzenia dwóch związków tytanu z chlorem zestawiono w poniższej tabeli.

Reakcja tlenku tytanu(IV) – o wzorze TiO2 – z tetrachlorometanem w temperaturze 500 °C prowadzi do powstania chlorku tytanu(IV) oraz tlenku węgla(IV) (reakcja 1.). Z kolei chlorek tytanu(II) – jako jedyny produkt reakcji – można otrzymać w wyniku przepuszczania par chlorku tytanu(IV) w temperaturze 1040 °C nad metalicznym tytanem (reakcja 2.).
Na podstawie: L. Kolditz, Chemia nieorganiczna, Warszawa 1994.
Uzupełnij poniższy schemat, tak aby przedstawiał on graficzny (klatkowy) zapis konfiguracji elektronowej jonu Ti2+ w stanie podstawowym. W zapisie uwzględnij numer powłoki i symbol podpowłoki.
Wybór właściwych wyrazów w zdaniach dotyczących tytanu oraz jego chlorków. Zadanie 3.1. Arkusz CKE chemia czerwiec 2024 rozszerzony formuła 2015 (1 punkt)
Tytan jest lekkim metalem odpornym na korozję. W zależności od stopnia utlenienia tytanu chlorki tego pierwiastka odznaczają się różnymi właściwościami fizycznymi. Wartości temperatury topnienia i temperatury wrzenia dwóch związków tytanu z chlorem zestawiono
w poniższej tabeli.

Reakcja tlenku tytanu(IV) – o wzorze TiO2 – z tetrachlorometanem w temperaturze 500 °C prowadzi do powstania chlorku tytanu(IV) oraz tlenku węgla(IV) (reakcja 1.). Z kolei chlorek tytanu(II) – jako jedyny produkt reakcji – można otrzymać w wyniku przepuszczania par chlorku tytanu(IV) w temperaturze 1040 °C nad metalicznym tytanem (reakcja 2.).
Na podstawie: L. Kolditz, Chemia nieorganiczna, Warszawa 1994.
Uzupełnij poniższe zdania dotyczące tytanu i jego chlorków. Wybierz i zaznacz jedno określenie spośród podanych w każdym nawiasie. Sieć krystaliczna metalicznego tytanu składa się z (atomów / kationów) otoczonych chmurą zdelokalizowanych elektronów. W sieci krystalicznej chlorku tytanu(II) obecne są (atomy / jony). Wraz z obniżeniem stopnia utlenienia tytanu w chlorkach (maleje / rośnie) jonowy charakter wiązania.