Obliczanie wprowadzonej liczby moli amoniaku, w celu powstania mieszaniny równowagowej o określonym składzie
Cyjanowodór jest cieczą wrzącą w temperaturze 299 K, a jego dawka śmiertelna wynosi 50 mg. Reakcję otrzymywania tego związku chemicznego opisuje równanie:
CH4(g) + NH3(g) ⇄ HCN(g) + 3H2(g) ΔHo = 252 kJ
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
W reaktorze o pojemności równej 1 dm3 umieszczono 4 mole metanu (CH4). Po wprowadzeniu do tego naczynia pewnej liczby moli amoniaku i ogrzaniu jego zawartości do temperatury T zainicjowano reakcję chemiczną, której stała równowagi w opisanych warunkach ma wartość 1.
Oblicz, jaką liczbę moli amoniaku wprowadzono do naczynia, jeśli w stanie równowagi liczba cząsteczek wodoru była taka sama, jak liczba cząsteczek metanu? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie stosunku molowego tlenku węgla(IV) i wodoru, w jakim powinny zostać zmieszane, w celu powstania mieszaniny równowagowej o określonym składzie
Podczas reakcji tlenku węgla(IV) z wodorem w naczyniu o pojemności 1 dm3, w pewnej temperaturze T ustala się równowaga, którą można przedstawić równaniem w postaci:
CO2(g) + H2(g) ⇄ CO(g) + H2O(g)
W opisanych warunkach stała równowagi tej reakcji chemicznej ma wartość 2.
Oblicz, w jakim stosunku molowym należy zmieszać tlenek węgla(IV) i wodór, aby po zainicjowaniu reakcji chemicznej i osiągnięciu stanu równowagi, w temperaturze T liczba moli wodoru była trzykrotnie mniejsza, niż liczba moli tlenku węgla(II)? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie wartości stałej równowagi reakcji chemicznej z udziałem tlenku azotu(IV)
W jednym z etapów produkcji kwasu azotowego(V) ustala się równowaga opisana równaniem:
2NO2(g) ⇄ N2O4(g)
W miarę obniżania temperatury ilość powstającego N2O4 stopniowo wzrasta i dochodzi do 80% objętościowych w temperaturze 300 K.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
Opisany proces prowadzono w reaktorze o pojemności równej 1 dm3.
Oblicz wartość stałej równowagi podanej reakcji chemicznej w temperaturze 300 K. Wynik podaj z dokładnością do cyfry jedności. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie wartości stałej równowagi reakcji odwrotnej do dimeryzacji tlenku azotu(IV)
W jednym z etapów produkcji kwasu azotowego(V) ustala się równowaga opisana równaniem:
2NO2(g) ⇄ N2O4(g)
W miarę obniżania temperatury ilość powstającego N2O4 stopniowo wzrasta i dochodzi do 80% objętościowych w temperaturze 300 K.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
Oblicz wartość stałej równowagi reakcji chemicznej prowadzącej do przekształcenia dimeru N2O4 w tlenek NO2 w temperaturze 300 K, jeśli proces ten prowadzono w reaktorze o pojemności równej 1 dm3. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie ilości energii wydzielonej na sposób ciepła w procesie tworzenia się określonej masy pary wodnej
Standardowa entalpia tworzenia pary wodnej wynosi –242 kJ·mol–1.
Oblicz, ile energii na sposób ciepła wydzieli się, jeśli powstanie 7,2 g pary wodnej, w reakcji przedstawionej równaniem: 2H2(g) + O2(g) → 2H2O(g) © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Pojemność naczynia zawierającego przesublimowany tlenek węgla(IV) (równanie Clapeyrona)
Tak zwany „suchy lód” to tlenek węgla(IV) o wzorze CO2 w stałym stanie skupienia. Gęstość suchego lodu wynosi 1,2 g/cm3.
Oblicz pojemność, jaką powinien mieć całkowicie pozbawiony powietrza, szczelnie zamykany pojemnik, aby po umieszczeniu w nim kostki „suchego lodu” o objętości równej 10 cm3 i jego przesublimowaniu w temperaturze 25 ⁰C uzyskać ciśnienie równe normalnemu? Wynik podaj z dokładnością do trzech cyfr znaczących. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Objętość próbki amoniaku o określonej masie (równanie Clapeyrona)
Uniwersalna stała gazowa ma wartość równą 83,1 hPa∙dm3∙mol–1∙K–1.
Oblicz, jaką objętość w temperaturze równej 20 ⁰C pod ciśnieniem normalnym zajmuje próbka amoniaku (NH3) o masie 4,25 kg? Wynik podaj w metrach sześciennych. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Ocena, czy mamy do czynienia z reakcją równowagową wraz z uzasadnieniem
Produkty docelowe wielu procesów w technologii chemicznej powstają na skutek przebiegu kilku reakcji następczych. Rysunek poniżej przedstawia zmiany stężeń reagentów (A÷D) układu reakcyjnego w czasie prowadzenia pewnego procesu technologicznego, któremu towarzyszą dwie reakcje chemiczne.
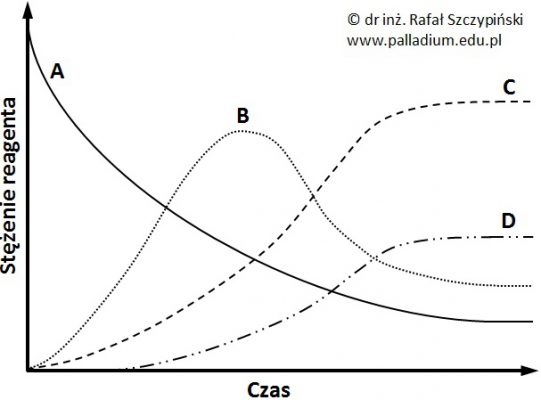
Na podstawie: I. P. Muchlenow i inni, Ogólna technologia chemiczna, Warszawa 1974.
Na podstawie zamieszczonego wykresu określ, czy w układzie tym ustalił się stan równowagi dynamicznej? Uzasadnij swoje stanowisko. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wybór odpowiedniego procesu technologicznego na podstawie wykresu zmian stężeń reagentów w czasie wraz z uzasadnieniem
Produkty docelowe wielu procesów w technologii chemicznej powstają na skutek przebiegu kilku reakcji następczych. Rysunek poniżej przedstawia zmiany stężeń reagentów (A÷D) układu reakcyjnego w czasie prowadzenia pewnego procesu technologicznego, któremu towarzyszą dwie reakcje chemiczne.

W tabeli poniżej zebrano dane na temat trzech niezależnych od siebie procesów chemicznych, podczas których biegną po dwie reakcje chemiczne.

Na podstawie: I. P. Muchlenow i inni, Ogólna technologia chemiczna, Warszawa 1974.
Spośród procesów (1÷3) podanych w tabeli wybierz jeden, którego reagentom można przypisać wykres zmian ich stężeń przedstawiony w informacji wprowadzającej. Uzasadnij swój wybór. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone

