Objętość gazu, w jakiej znajduje się określona liczba jego cząsteczek (warunki normalne)
W warunkach normalnych tlenek azotu(II) o wzorze NO jest bezbarwnym, bezwonnym gazem.
W jakiej objętości tlenku azotu(II) odmierzonego w warunkach normalnych znajduje się 1,505·1021 cząsteczek tego gazu? Wynik obliczeń podaj w centymetrach sześciennych. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wybór czynności wpływającej na zwiększenie wydajności reakcji wraz z uzasadnieniem
Cyjanowodór jest cieczą wrzącą w temperaturze 299 K, a jego dawka śmiertelna wynosi 50 mg. Reakcję otrzymywania tego związku chemicznego opisuje równanie:
CH4(g) + NH3(g) ⇄ HCN(g) + 3H2(g) ΔHo = 252 kJ
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
Opisaną reakcję prowadzono w reaktorze o stałej pojemności.
Jaką czynność należy wykonać, w celu zwiększenia wydajności reakcji tworzenia cyjanowodoru, jeśli nie możemy dostarczać do układu oraz usuwać z niego żadnych substancji? Odpowiedź uzasadnij. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Liczba moli cząsteczek metanu w określonej jego objętości (warunki normalne)
Metan (CH4) jest głównym składnikiem gazu ziemnego.
Oblicz liczbę moli cząsteczek znajdujących się w 2,8 dm3 metanu odmierzonego w warunkach normalnych. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Liczba cząsteczek metanu w określonej jego objętości (równanie Clapeyrona)
Metan (CH4) jest głównym składnikiem gazu ziemnego.
Oblicz liczbę cząsteczek znajdujących się w 2,8 dm3 metanu odmierzonego pod ciśnieniem 990 hPa i w temperaturze 62 ⁰C. Przyjmij, że uniwersalna stała gazowa ma wartość 83,1 hPa∙dm3∙mol–1∙K–1. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
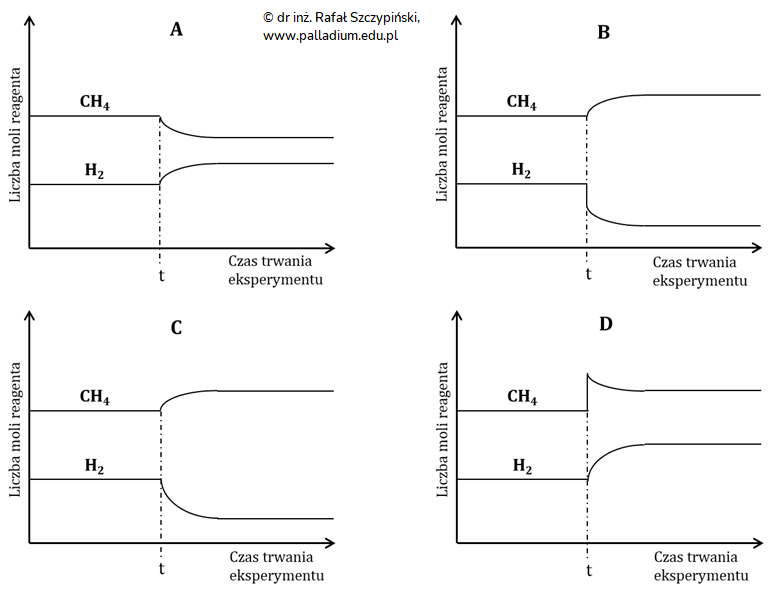
Ocena poprawności zdań dotyczących reakcji syntezy gazu syntezowego (reguła przekory)
Podczas produkcji gazu syntezowego w jednym z etapów procesu ustala się równowaga dynamiczna opisana równaniem:
CH4(g) + H2O(g) ⇄ CO(g) + 3H2(g) ∆Ho = 206 kJ
Na podstawie: K. Schmidt-Szałowski i inni, Technologia chemiczna. Przemysł nieorganiczny, Warszawa 2013.
Oceń poprawność poniższych zdań wpisując literę „P” (prawda) lub literę „F” (fałsz). 1. Usunięcie powstałego wodoru spowoduje przesunięcie stanu równowagi tej reakcji w prawo. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
2. Przebiegowi opisanej reakcji chemicznej towarzyszy wydzielanie się energii na sposób ciepła.
3. W warunkach izotermicznych wprowadzenie dodatkowej porcji metanu nie spowoduje zmiany wartości stałej równowagi tej reakcji chemicznej.
Przyporządkowanie wartości wydajności procesu do temperatury jego prowadzenia
Przebiegającą w fazie gazowej pirolizę metanu opisuje równanie stechiometryczne:
2CH4 ⇄ C2H2 + 3H2 ΔHo = 381 kJ
W zależności od temperatury prowadzenia procesu, wydajność procentowa tworzenia acetylenu przyjmuje wartości: 0,0%, 1,5%, 11,8%, 46,2%, 96,5% oraz 99,7%.
Na podstawie: I. P. Muchlenow i inni, Ogólna technologia chemiczna, Warszawa 1974.
W tabeli poniżej zebrano dane na temat temperatur, w jakich prowadzono pirolizę metanu.
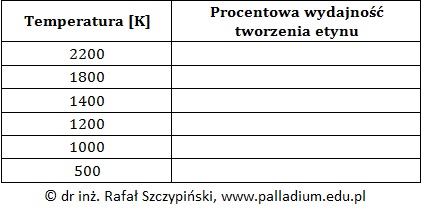
Przyporządkuj podane w informacji wprowadzającej wartości procentowej wydajności tworzenia acetylenu do odpowiedniej temperatury, w jakiej przebiegała reakcja. Uzasadnij swoje stanowisko. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone