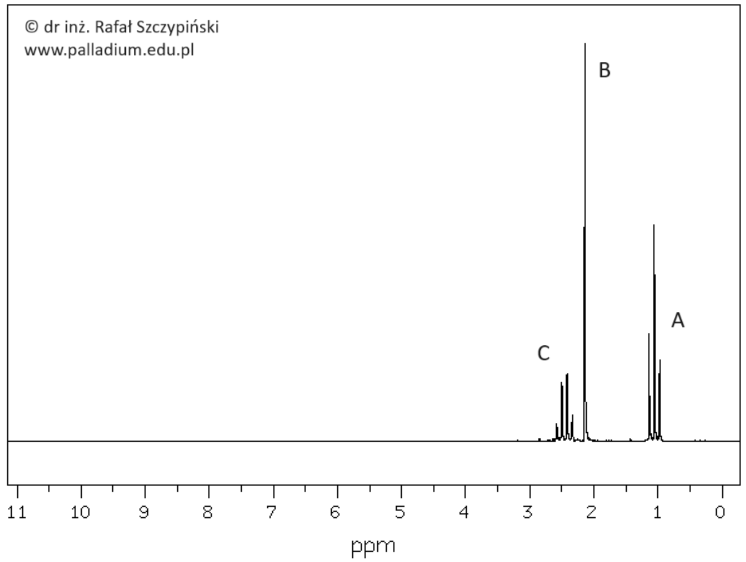
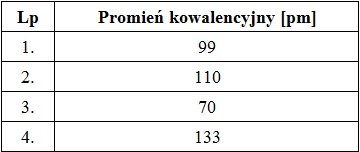
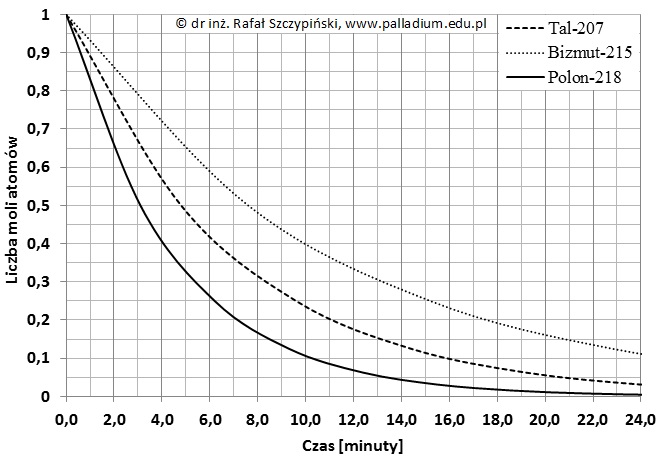
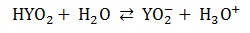Próba biuretowa z wykorzystaniem żelatyny spożywczej
W filmie przedstawiono możliwe do zaobserwowania zmiany (wraz z komentarzami) podczas próby biuretowej z wykorzystaniem żelatyny spożywczej.
© dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Tutorial: czy narysowana cząsteczka jest chiralna?
Na filmie omówiono, jak rozpoznać cząsteczki chiralne oraz czym jest stereoizomer mezo – wraz z przykładami.
Tutorial: jak rozpoznać cukier redukujący?
Z filmu dowiesz się jak na podstawie wzoru Hawortha można rozpoznać cukier redukujący oraz nieredukujący.
Tutorial: jak przekształcić stereoizomer D glukozy w stereoizomer L?
W filmie omówiony został sposób przekształcania stereoizomeru D-glukozy na przykładzie anomeru β (beta), zarówno dla formy łańcuchowej jak i wzoru Hawortha. Ponadto dowiesz się kiedy mamy do czynienia z anomerem α (alfa) oraz β (beta) monosacharydu w zależności od jego przynależności do szeregu konfiguracyjnego D lub L.