Zadanie 3. Zapis wzorów reduktorów oraz postaci do jakich są utleniane. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.1 (2 punkty)
W trzech probówkach znajdowały się roztwory – kwasu solnego, wodorotlenku potasu oraz siarczanu(IV) sodu. W celu odróżnienia zawartości naczyń do każdego z nich wprowadzono wodny roztwór manganianu(VII) potasu i lekko ogrzano. Zamieszczone fotografie przedstawiają zawartość probówek uzyskaną po wykonaniu opisanych czynności.

Uzupełnij puste pola w tabeli – wpisz wzór sumaryczny drobiny pełniącej rolę reduktora w danej probówce oraz wzór sumaryczny drobiny powstałej w wyniku jej utlenienia. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 4.1. Zapis równania reakcji chemicznej. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.1 (2 punkty)
W trzech probówkach znajdowały się roztwory – kwasu solnego, wodorotlenku potasu oraz siarczanu(IV) sodu. W celu odróżnienia zawartości naczyń do każdego z nich wprowadzono wodny roztwór manganianu(VII) potasu i lekko ogrzano. Zamieszczone fotografie przedstawiają zawartość probówek uzyskaną po wykonaniu opisanych czynności.

Drobiny, których obecność świadczy o barwie widocznej na 1. fotografii umownie oznaczono literą X. Zakwaszenie tej mieszaniny poreakcyjnej pozwala na szybkie przekształcenie jej w osad przedstawiony na 2. fotografii. Podczas takiej przemiany powstają również jony, których obecność świadczy o barwie fazy wodnej widocznej na fotografii A.

Napisz w formie jonowej skróconej równanie reakcji chemicznej jaka przebiega w trakcie opisanego procesu z udziałem drobin X. Współczynniki stechiometryczne uzgodnij metodą bilansu jonowo-elektronowego. Proces utleniania: Proces redukcji: Równanie sumaryczne: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 4.2. Określanie typu reakcji redoks. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.1 (1 punkt)
W trzech probówkach znajdowały się roztwory – kwasu solnego, wodorotlenku potasu oraz siarczanu(IV) sodu. W celu odróżnienia zawartości naczyń do każdego z nich wprowadzono wodny roztwór manganianu(VII) potasu i lekko ogrzano. Zamieszczone fotografie przedstawiają zawartość probówek uzyskaną po wykonaniu opisanych czynności.

Drobiny, których obecność świadczy o barwie widocznej na 1. fotografii umownie oznaczono literą X. Zakwaszenie tej mieszaniny poreakcyjnej pozwala na szybkie przekształcenie jej w osad przedstawiony na 2. fotografii. Podczas takiej przemiany powstają również jony, których obecność świadczy o barwie fazy wodnej widocznej na fotografii A.

Dokonaj klasyfikacji procesu redoks z udziałem drobin X. Podkreśl właściwe słowo w nawiasie. Uzasadnij swój wybór. Opisany proces jest przykładem reakcji (synproporcjonacji / dysproporcjonacji). Uzasadnienie: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 5. Zapis wzoru sumaryczne go związku oraz typu tworzonych kryształów. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.1 (1 punkt)
Fotografia 1. ilustruje pewien związek chemiczny X zawierający około 26,5% masowych potasu oraz tlen i pierwiastek bloku d. W stanie podstawowym atomu tego pierwiastka wszystkie elektrony walencyjne są niesparowane. Opisaną substancję wprowadzono do zlewki zawierającej wodę destylowaną i całkowicie rozpuszczono. Z uzyskanej mieszaniny pobrano następnie po 2 ml próbek i umieszczono w trzech probówkach. Do naczyń tych w sposób losowy oraz w nadmiarze wprowadzono roztwory – KOH, H2SO4 oraz wodę destylowaną. Efekt końcowy tego doświadczenia przedstawiają fotografie 2.–4.

Napisz wzór sumaryczny związku chemicznego X, a następnie określ rodzaj tworzonych przez tę substancję kryształów (kowalencyjne, molekularne, jonowe). Uzupełnij tabelę. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 6. Ocena, czy wskazany związek chemiczny wykazuje właściwości utleniające. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.1 (1 punkt)
Fotografia 1. ilustruje pewien związek chemiczny X zawierający około 26,5% masowych potasu oraz tlen i pierwiastek bloku d. W stanie podstawowym atomu tego pierwiastka wszystkie elektrony walencyjne są niesparowane. Opisaną substancję wprowadzono do zlewki zawierającej wodę destylowaną i całkowicie rozpuszczono. Z uzyskanej mieszaniny pobrano następnie po 2 ml próbek i umieszczono w trzech probówkach. Do naczyń tych w sposób losowy oraz w nadmiarze wprowadzono roztwory – KOH, H2SO4 oraz wodę destylowaną. Efekt końcowy tego doświadczenia przedstawiają fotografie 2.–4.

Oceń, czy przeprowadzone doświadczenie pozwala stwierdzić, że związek chemiczny X wykazuje właściwości utleniające. Uzasadnij odpowiedź. Ocena: Uzasadnienie: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 8.2. Zapis podpowłokowej konfiguracji elektronowej jonu. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.1 (1 punkt)
Fotografia 1. ilustruje pewien związek chemiczny X zawierający około 26,5% masowych potasu oraz tlen i pierwiastek bloku d. W stanie podstawowym atomu tego pierwiastka wszystkie elektrony walencyjne są niesparowane. Opisaną substancję wprowadzono do zlewki zawierającej wodę destylowaną i całkowicie rozpuszczono. Z uzyskanej mieszaniny pobrano następnie po 2 ml próbek i umieszczono w trzech probówkach. Do naczyń tych w sposób losowy oraz w nadmiarze wprowadzono roztwory – KOH, H2SO4 oraz wodę destylowaną. Efekt końcowy tego doświadczenia przedstawiają fotografie 2.–4.

Do zawartości jednej z probówek widocznych na fotografiach 2.–4. wprowadzono wodny roztwór pewnego związku chemicznego. Standardowy potencjał redukcji półogniwa, w którym związek ten stanowi formę zredukowaną wynosi 0,695 V. Zamieszczona poniżej fotografia została wykonana w trakcie przebiegu opisanej reakcji chemicznej.

Napisz stosując symbole podpowłok pełną konfigurację elektronową powstającego jonu, którego obecność przyczynia się do zmiany zabarwienia roztworu na widoczny kolor. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 9.1. Wskazanie właściwej fotografii oraz zapis wzoru sumarycznego związku chemicznego. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.1 (1 punkt)
Przeprowadzono doświadczenie chemiczne według schematu:

Fotografia 1. przedstawia tlenek chromu(III). Zawartość probówki 2. stanowi klarowny roztwór, w którym występują jony kompleksowe o liczbie koordynacyjnej 6, natomiast w probówce 3. znajduje się zawiesina pewnego związku chromu.
Jeśli do zalkalizowanej zawartości probówki 2. wprowadzony zostanie nadtlenek wodoru, wówczas powstanie roztwór zawierający związek chemiczny, którego krystaliczną postać przedstawia jedna z fotografii:

Wskaż fotografię (A, B lub C) przedstawiającą związek chemiczny, którego roztwór uzyskano w wyniku przebiegu opisanej reakcji chemicznej. Napisz jego wzór sumaryczny. Wybrana fotografia: Wzór sumaryczny: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 9.2. Zapis równania reakcji chemicznej. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.1 (2 punkty)
Przeprowadzono doświadczenie chemiczne według schematu:

Fotografia 1. przedstawia tlenek chromu(III). Zawartość probówki 2. stanowi klarowny roztwór, w którym występują jony kompleksowe o liczbie koordynacyjnej 6, natomiast w probówce 3. znajduje się zawiesina pewnego związku chromu.
Jeśli do zalkalizowanej zawartości probówki 2. wprowadzony zostanie nadtlenek wodoru, wówczas powstanie roztwór zawierający związek chemiczny, którego krystaliczną postać przedstawia jedna z fotografii:

Napisz w formie jonowej skróconej równanie reakcji chemicznej jaka przebiegła. Współczynniki stechiometryczne uzgodnij metodą bilansu jonowo-elektronowego. Proces utleniania: Proces redukcji: Równanie sumaryczne: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 10. Wskazanie właściwej fotografii oraz zapis równania reakcji chemicznej. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.1 (1 punkt)
Przeprowadzono doświadczenie chemiczne według schematu:

Fotografia 1. przedstawia tlenek chromu(III). Zawartość probówki 2. stanowi klarowny roztwór, w którym występują jony kompleksowe o liczbie koordynacyjnej 6, natomiast w probówce 3. znajduje się zawiesina pewnego związku chromu.
Związek przedstawiony na 1. fotografii wprowadzono do niewielkiego nadmiaru roztworu kwasu siarkowego(VI). Uzyskano wówczas mieszaninę przedstawioną na jednaj z fotografii (A, B, C lub D).

Wskaż oznaczenie literowe właściwej fotografii. Odpowiedź uzasadnij równaniem reakcji chemicznej zapisanym w formie jonowej skróconej. Wybrana fotografia: Równanie reakcji: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 11. Zapis równania reakcji chemicznej oraz wyjaśnienie dlaczego nie jest to reakcja redoks. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.1 (2 punkty)
Przeprowadzono doświadczenie chemiczne według schematu:

Fotografia 1. przedstawia tlenek chromu(III). Zawartość probówki 2. stanowi klarowny roztwór, w którym występują jony kompleksowe o liczbie koordynacyjnej 6, natomiast w probówce 3. znajduje się zawiesina pewnego związku chromu.
Napisz w formie jonowej skróconej równanie reakcji chemicznej, której przebieg doprowadził do uzyskania zawartości widocznej na 3. fotografii. Wyjaśnij, dlaczego opisanej przemiany nie można nazwać reakcją redoks. Równanie reakcji: Wyjaśnienie: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 12. Zapis wzorów sumarycznych związków chemicznych. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.1 (1 punkt)
Przeprowadzono doświadczenie chemiczne według schematu:
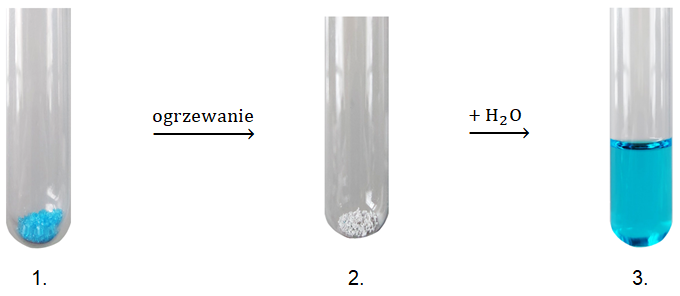
Substancja znajdująca się w 1. probówce jest pięciowodnym hydratem pochodzącym od mocnego, dwuprotonowego kwasu i zawiera 25,6% masowych kationów X2+. Związek chemiczny w 2. probówce jest solą bezwodną, zawierającą 40% masowych takich samych kationów metalu co hydrat. Konfiguracja elektronowa drobin X2+ w stanie podstawowym może być przedstawiona w postaci [Ar] 3d9.
Napisz wzory sumaryczne ciał stałych znajdujących się w probówkach 1. oraz 2. 1.: 2.: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 13. Zapis wzoru sumarycznego akwakompleksu. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.1 (1 punkt)
Przeprowadzono doświadczenie chemiczne według schematu:

Substancja znajdująca się w 1. probówce jest pięciowodnym hydratem pochodzącym od mocnego, dwuprotonowego kwasu i zawiera 25,6% masowych kationów X2+. Związek chemiczny w 2. probówce jest solą bezwodną, zawierającą 40% masowych takich samych kationów metalu co hydrat. Konfiguracja elektronowa drobin X2+ w stanie podstawowym może być przedstawiona w postaci [Ar] 3d9.
Roztwór w probówce 3. zawdzięcza swą barwę obecności jonów kompleksowych o liczbie koordynacyjnej 6, w których jonem centralnym są drobiny X2+, a cząsteczki wody – ligandami.
Napisz wzór sumaryczny opisanych akwakompleksów. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone


