Zadanie 8. Wybór właściwej fotografii z uzasadnieniem. Doświadczenia chemiczne w zadaniach część 1. Rozdział 3 (1 punkt)
W dwóch kolbach przedstawionych na fotografiach 1. oraz 2. umieszczono w sposób losowy świeżo pobrane z butelek – nasycony roztwór tlenku węgla(IV) oraz 25-procentowy roztwór wody amoniakalnej.

Wskaż numer tego naczynia, w którym znajduje się związek chemiczny trudniej rozpuszczalny w wodzie. Odpowiedź uzasadnij odnosząc się do polarności (lub jej braku) cząsteczek tej substancji. Numer wybranej kolby: Uzasadnienie: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 9.1. Wybór właściwego zakresu pH roztworu. Doświadczenia chemiczne w zadaniach część 1. Rozdział 3 (1 punkt)
W dwóch kolbach przedstawionych na fotografiach 1. oraz 2. umieszczono w sposób losowy świeżo pobrane z butelek – nasycony roztwór tlenku węgla(IV) oraz 25-procentowy roztwór wody amoniakalnej.

W wyniku zmieszania w odpowiednich warunkach wymienionych roztworów można uzyskać w temperaturze 25 oC roztwór soli obojętnej, w którym ustalają się równowagi jonowe z udziałem obecnych w nim drobin.
Spośród podanych – wartości oraz zakresów pH podkreśl tę, która najlepiej odpowiada takiej mieszaninie. Uzasadnij odpowiedź. pH < 7 pH = 7 pH > 7 Uzasadnienie: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 9.2. Wyjaśnienie przyczyny lepszego przewodnictwa roztworu. Doświadczenia chemiczne w zadaniach część 1. Rozdział 3 (1 punkt)
W dwóch kolbach przedstawionych na fotografiach 1. oraz 2. umieszczono w sposób losowy świeżo pobrane z butelek – nasycony roztwór tlenku węgla(IV) oraz 25-procentowy roztwór wody amoniakalnej.

W wyniku zmieszania w odpowiednich warunkach wymienionych roztworów można uzyskać w temperaturze 25 oC roztwór soli obojętnej, w którym ustalają się równowagi jonowe z udziałem obecnych w nim drobin.
Wyjaśnij, dlaczego powstały w opisany sposób roztwór o wiele lepiej przewodzi prąd elektryczny, niż każdy z roztworów przed ich zmieszaniem? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 12. Zapis nazwy zjawiska oraz określenie zmiany rozpuszczalności hydratu. Doświadczenia chemiczne w zadaniach część 1. Rozdział 3 (1 punkt)
Rozpuszczalność w wodzie hydratu CuSO4∙5H2O zmienia się wraz ze zmianami temperatury. Zdjęcie 1. ilustruje nasycony w temperaturze 45 oC roztwór siarczanu(VI) miedzi(II), natomiast fotografia 2. wykonana została po doprowadzeniu zawartości tego naczynia do temperatury 22 oC.

Napisz nazwę zjawiska, w wyniku którego powstała mieszanina widoczna na 2. fotografii, a następnie podkreśl właściwe słowo w nawiasie określając, jak zmienia się rozpuszczalność tego hydratu w zakresie temperatur 22 oC – 45 oC. Nazwa zjawiska: We wskazanym zakresie temperatur rozpuszczalność CuSO4∙5H2O (rośnie / maleje). © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 13. Obliczanie rozpuszczalności hydratu. Doświadczenia chemiczne w zadaniach część 1. Rozdział 3 (2 punkty)
Rozpuszczalność w wodzie hydratu CuSO4∙5H2O zmienia się wraz ze zmianami temperatury. Zdjęcie 1. ilustruje nasycony w temperaturze 45 oC roztwór siarczanu(VI) miedzi(II), natomiast fotografia 2. wykonana została po doprowadzeniu zawartości tego naczynia do temperatury 22 oC.

Przygotowany w temperaturze 45 oC roztwór (fotografia 1.) zawierał 60,5 g wody, która stanowiła 76,4% jego masy.
Oblicz wyrażoną w g/100 g wody rozpuszczalność siarczanu(VI) miedzi(II)-woda (1/5) w temperaturze 45 oC. Wynik podaj z dokładnością do pierwszego miejsca po przecinku. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 14. Wskazanie numeru probówki o większym stężeniu jonów miedzi(II). Doświadczenia chemiczne w zadaniach część 1. Rozdział 3 (1 punkt)
Rozpuszczalność w wodzie hydratu CuSO4∙5H2O zmienia się wraz ze zmianami temperatury. Zdjęcie 1. ilustruje nasycony w temperaturze 45 oC roztwór siarczanu(VI) miedzi(II), natomiast fotografia 2. wykonana została po doprowadzeniu zawartości tego naczynia do temperatury 22 oC.

Z każdego spośród naczyń pobrano po 2 cm3 fazy ciekłej i umieszczono w dwóch probówkach oznaczonych takimi samymi numerami jak zlewki.
Wskaż numer tej z nich, w której znajduje się roztwór o wyższym stężeniu molowym jonów miedzi(II). © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 1. Zapis skróconej elektronowej konfiguracji podpowłokowej. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.1 (1 punkt)
O pewnym pierwiastku chemicznym X wiadomo, że w stanie podstawowym zarówno jego atom jak i dwudodatni jon zawierają po pięć elektronów niesparowanych. Zamieszczone fotografie ilustrują związki tego pierwiastka, w których występuje on na najniższym (fotografia 1.) oraz najwyższym (fotografia 2.) stopniu utlenienia.

Stosując symbole podpowłok napisz skróconą (względem poprzedzającego gazu szlachetnego) konfigurację elektronową atomu pierwiastka X w stanie podstawowym. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 2.1. Zapis równania reakcji chemicznej. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.1 (2 punkty)
O pewnym pierwiastku chemicznym X wiadomo, że w stanie podstawowym zarówno jego atom jak i dwudodatni jon zawierają po pięć elektronów niesparowanych. Zamieszczone fotografie ilustrują związki tego pierwiastka, w których występuje on na najniższym (fotografia 1.) oraz najwyższym (fotografia 2.) stopniu utlenienia.

Substancje widoczne na fotografiach 1. oraz 2. umieszczono w zlewkach, w których znajdowała się woda destylowana w takich ilościach, że uzyskano klarowne roztwory. Próbki powstałych mieszanin wprowadzono następnie do tej samej probówki, co dało efekt końcowy widoczny na zamieszczonej poniżej fotografii.

Napisz w formie jonowej skróconej równanie reakcji chemicznej jaka przebiegła. Zastosuj metodę bilansu jonowo-elektronowego. W równaniach reakcji połówkowych uwzględnij, że jednym z substratów jest woda. Proces utleniania: Proces redukcji: Równanie sumaryczne: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 2.2. Wybór probówki oraz zapis równania reakcji chemicznej. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.1 (1 punkt)
O pewnym pierwiastku chemicznym X wiadomo, że w stanie podstawowym zarówno jego atom jak i dwudodatni jon zawierają po pięć elektronów niesparowanych. Zamieszczone fotografie ilustrują związki tego pierwiastka, w których występuje on na najniższym (fotografia 1.) oraz najwyższym (fotografia 2.) stopniu utlenienia.

Substancje widoczne na fotografiach 1. oraz 2. umieszczono w zlewkach, w których znajdowała się woda destylowana w takich ilościach, że uzyskano klarowne roztwory. Próbki powstałych mieszanin wprowadzono następnie do tej samej probówki, co dało efekt końcowy widoczny na zamieszczonej poniżej fotografii.

Przedstawioną na zamieszczonej fotografii zawiesinę można uzyskać również w wyniku reakcji zawartości jednej z probówek A, B lub C z nadtlenkiem wodoru.
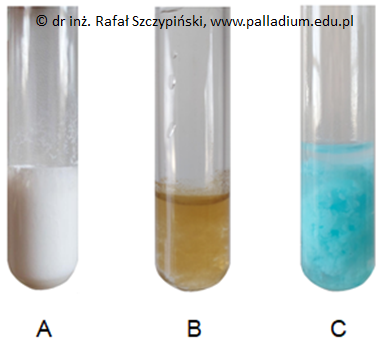
Wskaż właściwą probówkę (A, B lub C) oraz napisz równanie opisanej reakcji chemicznej. Oznaczenie probówki: Równanie reakcji: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone