Określanie wzoru sumarycznego związku chemicznego na podstawie opisu rozmieszczenia elektronów budujących go pierwiastków
O dwóch pierwiastkach X i Y wiadomo, że:
– ich elektrony walencyjne w stanie podstawowym zajmują tę samą powłokę elektronową, a liczba walencyjnych elektronów sparowanych jest dwukrotnie większa od liczby elektronów niesparowanych,
– drobiny Xa+ są izoelektronowe z atomami neonu, natomiast drobiny Yb– – z atomami argonu.
Pierwiastek X tworzy związek chemiczny z pewnym pierwiastkiem leżącym w tej samej grupie układu okresowego, co pierwiastek Y. Wiadomo, że w jego kryształach obecne są między innymi trójdodatnie jony.
Podaj wzór sumaryczny opisanego związku chemicznego oraz określ jego stan skupienia w warunkach normalnych. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zapis wzorów sumarycznych związków chemicznych zbudowanych z dwóch pierwiastków
Metale grup głównych układu okresowego mogą tworzyć związki chemiczne z niemetalami. Pierwiastki wykorzystują wtedy taką samą liczbę elektronów walencyjnych, jak w tworzonych przez nie wodorkach.
Wiedząc, że we wzorach sumarycznych tego rodzaju związków chemicznych jako pierwszy zapisywany jest symbol pierwiastka, który ma mniejszą wartość elektroujemności, napisz wzory sumaryczne związków o podanych nazwach. Azotek sodu – Fosforek wapnia – Borek glinu – Tellurek magnezu – © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie liczby moli niewiążących par elektronowych w próbce karwonu
Na rysunku poniżej przedstawiono wzór chemiczny związku organicznego o nazwie karwon. Niektóre z wiązań chemicznych w jego cząsteczce zostały ponumerowane cyframi od 1 do 6. Trzy atomy węgla oznaczono kolejnymi literami alfabetu.
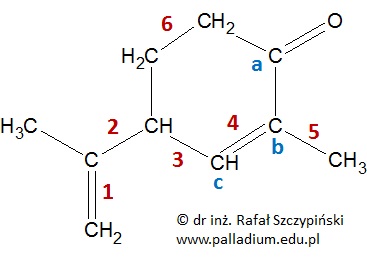
Podaj liczbę moli wszystkich walencyjnych niewiążących par elektronowych, znajdujących się w 0,25 mola cząsteczek karwonu. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie wzoru sumarycznego tlenku oraz kształtu jego cząsteczki
W stanie podstawowym, w atomie pewnego pierwiastka chemicznego X elektrony rozmieszczone są na pięciu powłokach elektronowych, przy czym:
– elektrony walencyjne zajmują wyłącznie jedną powłokę,
– sparowane elektrony walencyjne zajmują dwie podpowłoki i jest ich dwukrotnie więcej, niż walencyjnych elektronów niesparowanych.
Podaj wzór sumaryczny cząsteczki tlenku pierwiastka X, w którym pierwiastkowi temu przypisuje się jego najwyższy stopień utlenienia oraz określ kształt (liniowy, piramida trygonalna, trójkąt, tetraedr) tej cząsteczki. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Rysowanie wzoru elektronowego wodorku oraz tlenku rubidu
Cechą wspólną tlenków i wodorków litowców jest rodzaj występującego w nich wiązania chemicznego.
Narysuj wzory elektronowe – tlenku oraz wodorku rubidu i określ typ występującego w nich wiązania (jonowe, kowalencyjne, kowalencyjne spolaryzowane). © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Rysowanie wzoru elektronowego kreskowego cząsteczki wodorku oraz określanie jego budowy przestrzennej
W stanie podstawowym elektrony walencyjne pewnego pierwiastka X opisuje następująca konfiguracja klatkowa:

Wiadomo, że przy najwyższym stopniu utlenienia pierwiastek ten tworzy gazowy tlenek o charakterze kwasowym.
Narysuj wzór elektronowy (tzw. kropkowy lub kreskowy) cząsteczki wodorku pierwiastka X i określ jej kształt (trójkąt, piramida trygonalna, tetraedr). © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Uzasadnienie przyczyny asocjacji cząsteczek amoniaku
Cząsteczki antymonowodoru oraz amoniaku mają kształt piramidy trygonalnej.
Wyjaśnij, dlaczego pomimo podobnej budowy przestrzennej, cząsteczki antymonowodoru nie ulegają asocjacji, w porównaniu z cząsteczkami amoniaku? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Rysowanie wzorów elektronowych kreskowych cząsteczek oraz jonów
Dany jest zbiór indywiduów chemicznych:
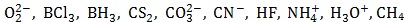
Narysuj wzory elektronowe kreskowe drobin (cząsteczek oraz jonów), których wzory sumaryczne przedstawione zostały w informacji wprowadzającej. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wybór elektrycznie obojętnych drobin, w których wiązania chemiczne utworzone zostały z wykorzystaniem wszystkich elektronów walencyjnych budujących je atomów
Dany jest zbiór indywiduów chemicznych:
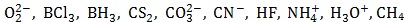
Wśród wymienionych drobin znajdują się elektrycznie obojętne te, w których wiązania chemiczne utworzone zostały z wykorzystaniem wszystkich elektronów walencyjnych budujących je atomów.
Podaj wzory drobin spełniających opisany wyżej warunek. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone

