Określanie typów oraz mechanizmów reakcji chemicznych. Zadanie 24.2. Arkusz CKE chemia maj 2024 rozszerzony (2 punkty)
Na poniższym schemacie przedstawiono ciąg przemian związków organicznych A, B i C:
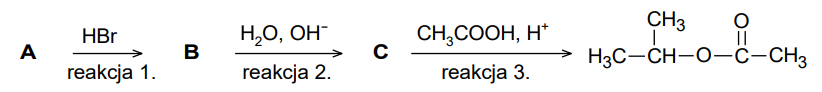
Określ typ reakcji (addycja, eliminacja, substytucja) oraz mechanizm (elektrofilowy, nukleofilowy, rodnikowy) reakcji oznaczonych na schemacie numerami 1. i 2.
Określanie wzoru elementarnego, rzeczywistego, wzorów półstrukturalnych oraz zapis równania reakcji chemicznej. Zadanie 25. Arkusz CKE chemia maj 2024 rozszerzony (4 punkty) zadanie problemowe
Trzy związki organiczne X, Y i Q są izomerami o masie molowej równej 90 g∙mol–1. W wyniku spalenia 45 mg jednego z tych związków otrzymano 27 mg wody oraz 36,0 cm3 tlenku węgla(IV) odmierzonego w temperaturze 293 K i pod ciśnieniem 1013 hPa. O cząsteczkach tych związków wiadomo, że:
– szkielet każdej z cząsteczek stanowią połączone atomy węgla
– cząsteczki związków X i Y są chiralne, a związku Q – achiralne
– cząsteczki związków Y i Q mają takie same grupy funkcyjne
– odczyn wodnego roztworu związku X jest obojętny, a odczyn wodnego roztworu związku Y – kwasowy.
Przeprowadzono następujące doświadczenie: do próbki związku X wprowadzono zawiesinę świeżo strąconego Cu(OH)2, wymieszano (na zimno), a następnie ogrzano. Wyniki tego eksperymentu zilustrowano na poniższych zdjęciach.

Na podstawie obliczeń ustal wzór elementarny i rzeczywisty (sumaryczny) opisanych związków. Następnie napisz: – wzory półstrukturalne (grupowe) związków X i Y – w formie cząsteczkowej równanie reakcji związku Q z wodorotlenkiem sodu. Zastosuj wzory półstrukturalne (grupowe) związków organicznych. Uniwersalna stała gazowa R = 83,14 hPa∙dm3∙mol–1∙K–1. Wzór elementarny związków: Wzór sumaryczny związków: Wzór półstrukturalny związku X: Wzór półstrukturalny związku Y: Równanie reakcji związku Q z wodorotlenkiem sodu:
Zapis równania reakcji chemicznej zgodnie z teorią Brønsteda. Zadanie 26. Arkusz CKE chemia maj 2024 rozszerzony (1 punkt)
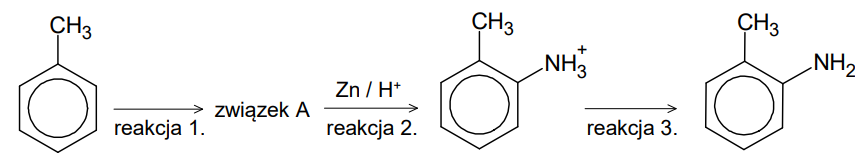
Przeprowadzono reakcje zgodnie ze schematem:
Wpisz do schematu wzory odpowiednich drobin, tak aby powstało równanie reakcji 3. w formie jonowej skróconej. Zastosuj definicję kwasu i zasady Brønsteda.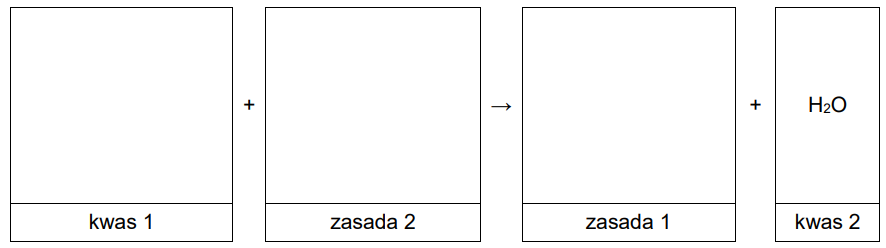
Zapis wzoru produktu reakcji oraz określenie czy jest to proces redoks. Zadanie 27. Arkusz CKE chemia maj 2024 rozszerzony (1 punkt)
Przeprowadzono reakcje zgodnie ze schematem:

Organiczny związek otrzymany w reakcji 3. zmieszano z bromem (w stosunku molowym 1 : 1) i poddano reakcji w obecności światła.
Narysuj wzór półstrukturalny lub uproszczony organicznego produktu opisanej reakcji i uzupełnij zdanie. Wybierz i zaznacz właściwą odpowiedź spośród podanych w nawiasie. Wzór produktu reakcji: Opisana przemiana (jest / nie jest) reakcją utlenienia-redukcji.
Zapis form fenyloalaniny występujących w danym środowisku. Zadanie 28. Arkusz CKE chemia maj 2024 rozszerzony (2 punkty)
Przeprowadzono doświadczenie zilustrowane na poniższym rysunku:
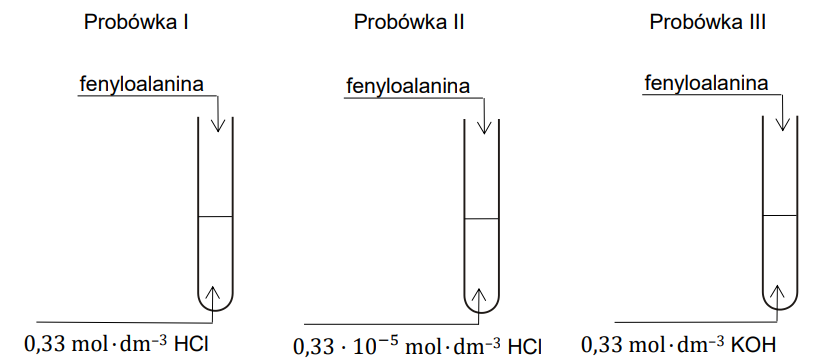
Uzupełnij poniższe schematy, tak aby powstały wzory półstrukturalne (grupowe) fenyloalaniny w postaci, w której ten aminokwas będzie występował w dominującej formie w roztworze w każdej probówce.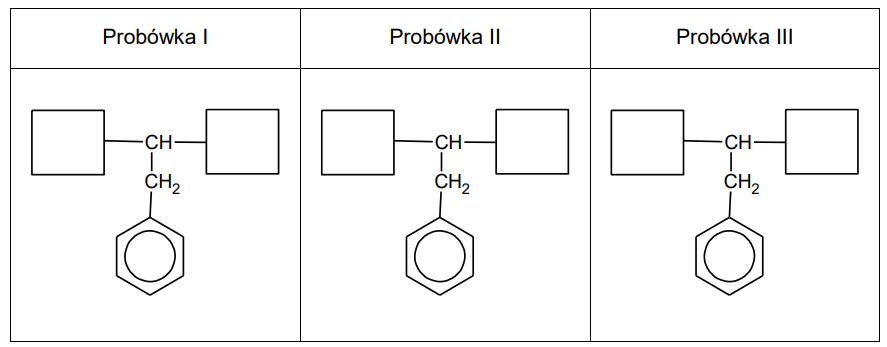
Rozstrzygnięcie, czy degradacja Ruffa D-mannozy prowadzi do otrzymania tej samej aldopentozy, co degradacja Ruffa D-glukozy. Zadanie 29. Arkusz CKE chemia maj 2024 rozszerzony (1 punkt)
Degradacja Ruffa to dwuetapowa reakcja, która pozwala na skrócenie łańcucha cząsteczki aldozy o jeden atom węgla. Pierwszy etap procesu to utlenienie aldozy do kwasu aldonowego za pomocą wody bromowej. W drugim etapie kwas aldonowy jest utleniany nadtlenkiem wodoru w obecności siarczanu(VI) żelaza(III), co prowadzi do otrzymania aldozy o krótszym łańcuchu węglowym i tlenku węgla(IV).
Na podstawie: R.T. Morrison, R.N. Boyd, Chemia organiczna, Warszawa 2011.
Poniżej przedstawiono schemat degradacji Ruffa, w której D-glukoza przekształca się w D-arabinozę:
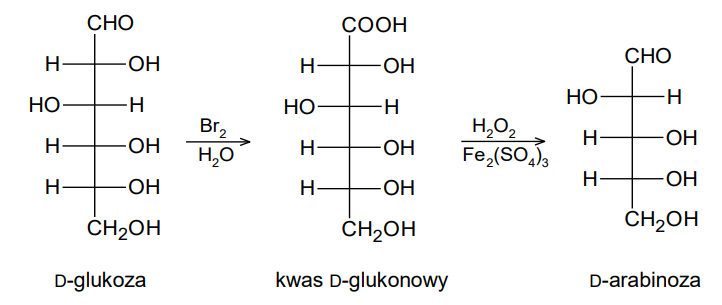
Rozstrzygnij, czy degradacja Ruffa D-mannozy prowadzi do otrzymania tej samej aldopentozy, co degradacja Ruffa D-glukozy. Odpowiedź uzasadnij. W uzasadnieniu porównaj budowę cząsteczek obu aldoheksoz. Wzór D-mannozy: Rozstrzygnięcie: Uzasadnienie: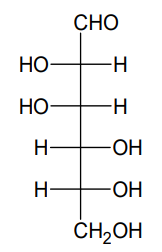
Wybór właściwego cukru użytego podczas reakcji chemicznej. Zadanie 30. Arkusz CKE chemia maj 2024 rozszerzony (1 punkt)
Degradacja Ruffa to dwuetapowa reakcja, która pozwala na skrócenie łańcucha cząsteczki aldozy o jeden atom węgla. Pierwszy etap procesu to utlenienie aldozy do kwasu aldonowego za pomocą wody bromowej. W drugim etapie kwas aldonowy jest utleniany nadtlenkiem wodoru w obecności siarczanu(VI) żelaza(III), co prowadzi do otrzymania aldozy o krótszym łańcuchu węglowym i tlenku węgla(IV).
Na podstawie: R.T. Morrison, R.N. Boyd, Chemia organiczna, Warszawa 2011.
Poniżej przedstawiono schemat degradacji Ruffa, w której D-glukoza przekształca się w D-arabinozę:

Degradacji Ruffa poddano jeden ze związków, których wzory przedstawiono poniżej. Powstały cukier utleniono kwasem azotowym(V) i otrzymano związek, którego cząsteczki są achiralne – kwas mezo-winowy.
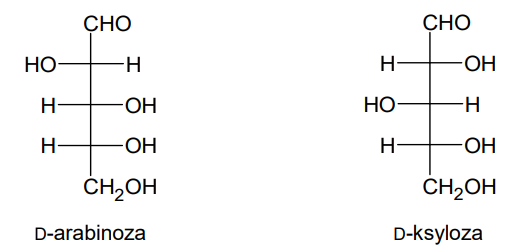
Wybierz cukier, którego użyto do przeprowadzenia opisanego doświadczenia, i napisz nazwę tego cukru.