Określanie liczb wiązań sigma, pi oraz wolnych par elektronowych w dwuatomowej cząsteczce. Zadanie 1.3. Arkusz CKE chemia maj 2018 rozszerzony (1 punkt)
Pierwiastki X i Z leżą w czwartym okresie układu okresowego. Pierwiastek X jest metalem, natomiast pierwiastek Z – niemetalem. W stanie podstawowym atomów obu tych pierwiastków tylko jeden elektron jest niesparowany. Znajduje się on na ostatniej powłoce. Niesparowany elektron atomu pierwiastka X znajduje się na innej podpowłoce niż niesparowany elektron atomu pierwiastka Z. Ponadto wiadomo, że pierwiastek X tworzy tlenki o wzorach X2O i XO oraz że ten metal jest jednym z najlepszych przewodników ciepła i elektryczności. Pierwiastek Z występuje w postaci dwuatomowych cząsteczek.
Dla cząsteczki Z2 określ liczbę: wiązań σ, wiązań π oraz wolnych par elektronowych.
Obliczanie masy atomowej jednego z izotopów galu. Zadanie 2. Arkusz CKE chemia maj 2018 rozszerzony (1 punkt)
Gal występuje w przyrodzie w postaci mieszaniny dwóch izotopów. Na 3 atomy pierwszego izotopu galu o masie atomowej 68,926 u przypadają 2 atomy drugiego izotopu galu o masie atomowej mx. Średnia masa atomowa galu jest równa 69,723 u.
Na podstawie: J. Sawicka i inni, Tablice chemiczne, Gdańsk 2002.
Na podstawie powyższych danych oblicz masę atomową mx drugiego izotopu galu. Wynik końcowy podaj z dokładnością do trzeciego miejsca po przecinku.
Obliczanie bezwzględnej masy jednego atomu izotopu galu. Zadanie 3. Arkusz CKE chemia maj 2018 rozszerzony (1 punkt)
Gal występuje w przyrodzie w postaci mieszaniny dwóch izotopów. Na 3 atomy pierwszego izotopu galu o masie atomowej 68,926 u przypadają 2 atomy drugiego izotopu galu o masie atomowej mx. Średnia masa atomowa galu jest równa 69,723 u.
Na podstawie: J. Sawicka i inni, Tablice chemiczne, Gdańsk 2002.
Na podstawie powyższych danych oblicz bezwzględną masę (wyrażoną w gramach) jednego atomu tego izotopu galu, który ma mniejszą masę atomową.
Zapis równań reakcji berylu z roztworem kwasu i roztworem zasady. Zadanie 4. Arkusz CKE chemia maj 2018 rozszerzony (2 punkty)
Beryl jest metalem, który reaguje z kwasami oraz ze stężonymi zasadami. Poniżej przedstawiono schemat reakcji berylu z kwasem i zasadą.
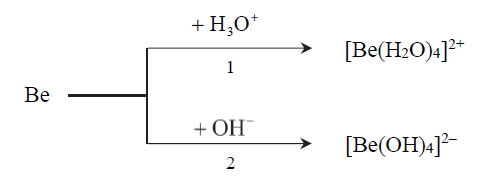
Napisz w formie jonowej skróconej równania reakcji oznaczonych numerami 1 i 2, wiedząc, że jednym z produktów obu przemian jest ten sam gaz. Uwzględnij tworzenie się kompleksowych jonów berylu. Równanie reakcji 1: Równanie reakcji 2:
Określanie efektu cieplnego reakcji tlenku węgla(IV) z węglem wraz z uzasadnieniem. Zadanie 5. Arkusz CKE chemia maj 2018 rozszerzony (1 punkt)
W wysokiej temperaturze węgiel reaguje z tlenkiem węgla(IV) i ustala się równowaga chemiczna:
CO2 (g) + C (s) ⇄ 2CO (g)
Objętościową zawartość procentową CO i CO2 w gazie pozostającym w równowadze z węglem w zależności od temperatury (pod ciśnieniem atmosferycznym 1013 hPa) przedstawiono na poniższym wykresie.
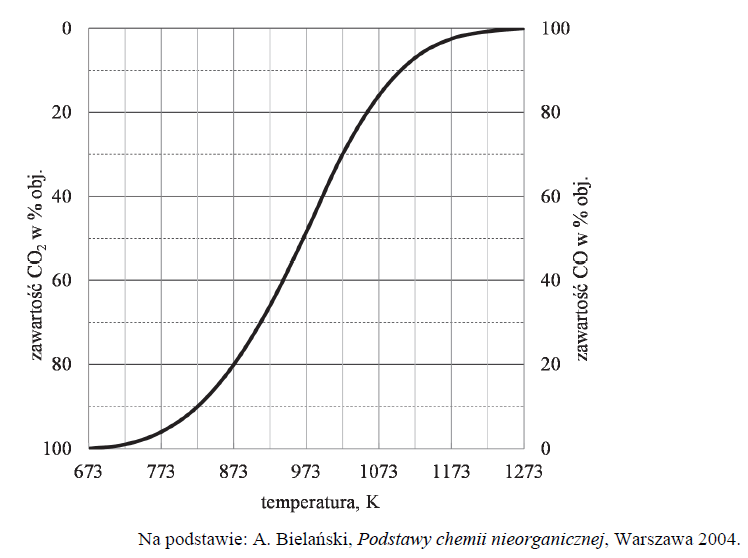
Oceń, czy reakcja pomiędzy tlenkiem węgla(IV) i węglem jest procesem endo- czy egzoenergetycznym. Odpowiedź uzasadnij.
Obliczanie procentu wagowego tlenu wchodzącego w skład związków chemicznych w stanie równowagi. Zadanie 6. Arkusz CKE chemia maj 2018 rozszerzony (2 punkty)
W wysokiej temperaturze węgiel reaguje z tlenkiem węgla(IV) i ustala się równowaga chemiczna:
CO2 (g) + C (s) ⇄ 2CO (g)
Objętościową zawartość procentową CO i CO2 w gazie pozostającym w równowadze z węglem w zależności od temperatury (pod ciśnieniem atmosferycznym 1013 hPa) przedstawiono na poniższym wykresie.

Oblicz wyrażoną w procentach masowych zawartość tlenu, wchodzącego w skład CO2 i CO, w pozostającej w równowadze mieszaninie tych związków z węglem w temperaturze 873 K i pod ciśnieniem 1013 hPa. Możesz przyjąć, że sumaryczna liczba moli gazowego substratu i gazowego produktu reakcji jest równa 1. W opisanych warunkach 1 mol gazu zajmuje objętość 71,6 dm3.
Ocena poprawności zdań dotyczących reakcji chemicznych biegnących w trzech probówkach. Zadanie 7. Arkusz CKE chemia maj 2018 rozszerzony (1 punkt)
Przeprowadzono doświadczenia, których przebieg zilustrowano na schemacie:
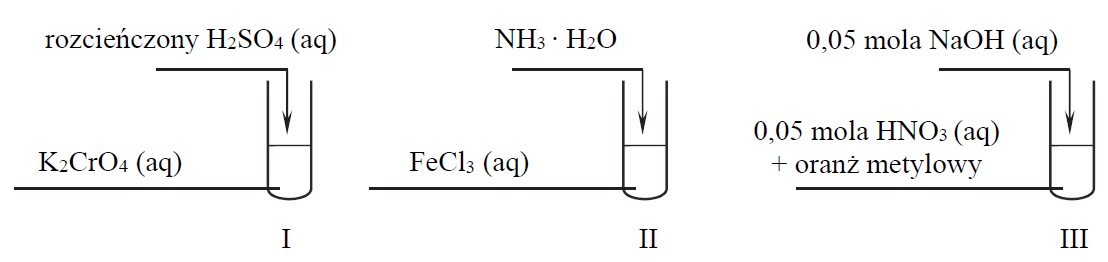
Oceń, czy poniższe informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa. 1. W dwóch probówkach nastąpiła zmiana barwy roztworów z żółtej na pomarańczową. 2. W jednej probówce roztwór zmienił barwę na zieloną. 3. W jednej probówce wytrącił się osad.
Projektowanie doświadczenia mającego na celu wykazanie w różnicy mocy kwasu solnego, węglowego oraz fenolu. Zadanie 8.1. Arkusz CKE chemia maj 2018 rozszerzony (1 punkt)
Za pomocą odpowiednio przeprowadzonych doświadczeń można porównać charakter kwasowy fenolu, kwasu solnego i kwasu węglowego.
Zaprojektuj jedno doświadczenie, którym potwierdzisz, że spośród wymienionych substancji najmocniejszym kwasem jest kwas solny, a najsłabszym – fenol. W tym celu uzupełnij schemat doświadczenia. Wpisz wzory wszystkich związków, których wodnych roztworów należy użyć w doświadczeniu. Substancje wybierz spośród następujących: C6H5ONa NaCl HCl Ca(OH)2 C6H5OH Na2CO3 Wszystkie roztwory były świeżo przygotowane.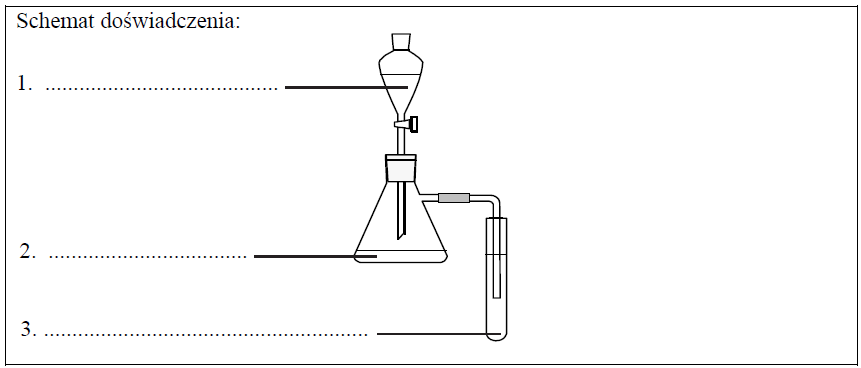
Opis obserwacji towarzyszących doświadczeniu z udziałem kwasu solnego oraz soli kwasu węglowego i fenolu. Zadanie 8.2. Arkusz CKE chemia maj 2018 rozszerzony (1 punkt)
Za pomocą odpowiednio przeprowadzonych doświadczeń można porównać charakter kwasowy fenolu, kwasu solnego i kwasu węglowego.
Napisz, co będzie można zaobserwować podczas przeprowadzonego doświadczenia. Kolba: Probówka:
Zapis równań reakcji biegnących podczas doświadczenia z udziałem kwasu solnego oraz soli kwasu węglowego i fenolu. Zadanie 8.3. Arkusz CKE chemia maj 2018 rozszerzony (2 punkty)
Za pomocą odpowiednio przeprowadzonych doświadczeń można porównać charakter kwasowy fenolu, kwasu solnego i kwasu węglowego.
Napisz w formie jonowej skróconej równania reakcji zachodzących w kolbie i w probówce podczas przeprowadzonego doświadczenia. Równanie reakcji zachodzącej w kolbie: Równanie reakcji zachodzącej w probówce:
Zapis równania autodysocjacji kwasu siarkowego(VI) ze wskazaniem kwasu Brønsteda. Zadanie 9.1. Arkusz CKE chemia maj 2018 rozszerzony (1 punkt)
Kwas siarkowy(VI) w temperaturze pokojowej jest oleistą cieczą o gęstości prawie dwukrotnie większej niż gęstość wody. Czysty, bezwodny kwas siarkowy(VI) ulega częściowej autodysocjacji, dzięki czemu przewodzi prąd elektryczny. W wyniku reakcji kwasu siarkowego(VI) z wodorotlenkiem sodu, w której stosunek molowy substratów jest równy 1 : 1, powstaje wodorosiarczan(VI) sodu. Wodny roztwór wodorosiarczanu(VI) sodu charakteryzuje się kwasowym odczynem, ponieważ jony obecne w roztworze ulegają reakcji zgodnie z poniższym równaniem:
HSO4– (aq) + H2O ⇄ SO42–(aq) + H3O+ (aq)
Stała równowagi opisanej reakcji w temperaturze T jest równa 1,0·10–2 .
Na podstawie: T. Mizerski, Tablice chemiczne, Warszawa 2004.
Napisz równanie autodysocjacji kwasu siarkowego(VI) polegającej na przeniesieniu protonu z jednej cząsteczki H2SO4 do drugiej. W równaniu podkreśl wzór kwasu Brønsteda sprzężonego z cząsteczką H2SO4 jako zasadą Brønsteda.
Obliczanie pH roztworu wodorosiarczanu(VI) sodu. Zadanie 9.2. Arkusz CKE chemia maj 2018 rozszerzony (2 punkty)
Kwas siarkowy(VI) w temperaturze pokojowej jest oleistą cieczą o gęstości prawie dwukrotnie większej niż gęstość wody. Czysty, bezwodny kwas siarkowy(VI) ulega częściowej autodysocjacji, dzięki czemu przewodzi prąd elektryczny. W wyniku reakcji kwasu siarkowego(VI) z wodorotlenkiem sodu, w której stosunek molowy substratów jest równy 1 : 1, powstaje wodorosiarczan(VI) sodu. Wodny roztwór wodorosiarczanu(VI) sodu charakteryzuje się kwasowym odczynem, ponieważ jony obecne w roztworze ulegają reakcji zgodnie z poniższym równaniem:
HSO4– (aq) + H2O ⇄ SO42–(aq) + H3O+ (aq)
Stała równowagi opisanej reakcji w temperaturze T jest równa 1,0·10–2 .
Na podstawie: T. Mizerski, Tablice chemiczne, Warszawa 2004.
Rozpuszczono 0,600 g NaHSO4 w wodzie i otrzymano 100 cm3 roztworu o temperaturze T. W tym roztworze reakcji z wodą uległo znacznie więcej niż 5% jonów wodorosiarczanowych(VI).
Oblicz pH tego roztworu. Wynik końcowy podaj z dokładnością do trzeciego miejsca po przecinku.
Uszeregowanie roztworów zgodnie ze wzrastającą wartością pH. Zadanie 10. Arkusz CKE chemia maj 2018 rozszerzony (1 punkt)
W temperaturze T przygotowano wodne roztwory pięciu elektrolitów o jednakowym stężeniu molowym równym 0,1 mol⋅dm−3 . Poniżej podano wzory tych elektrolitów.
KCl HCl NaNO2 NH4Cl KOH
Uszereguj związki o podanych wzorach zgodnie z rosnącym pH ich wodnych roztworów. Napisz wzory tych związków w odpowiedniej kolejności. najniższe pH najwyższe pH
Wybór wskaźnika użytego podczas miareczkowania roztworu kwasu octowego roztworem zasady sodowej. Zadanie 11. Arkusz CKE chemia maj 2018 rozszerzony (1 punkt)
Do wodnego roztworu kwasu etanowego (octowego) o określonej objętości, ale o nieznanym stężeniu, dodawano kroplami wodny roztwór wodorotlenku sodu o znanym stężeniu i za pomocą pehametru mierzono pH mieszaniny reakcyjnej. W ten sposób przeprowadzono tzw. miareczkowanie pehametryczne, które jest jedną z metod analizy ilościowej. W czasie doświadczenia zachodziła reakcja opisana równaniem:
CH3COOH + NaOH → CH3COONa + H2O
Zestaw użyty w tym doświadczeniu przedstawiono na poniższym schemacie, a otrzymane wyniki miareczkowania umieszczono na wykresie.
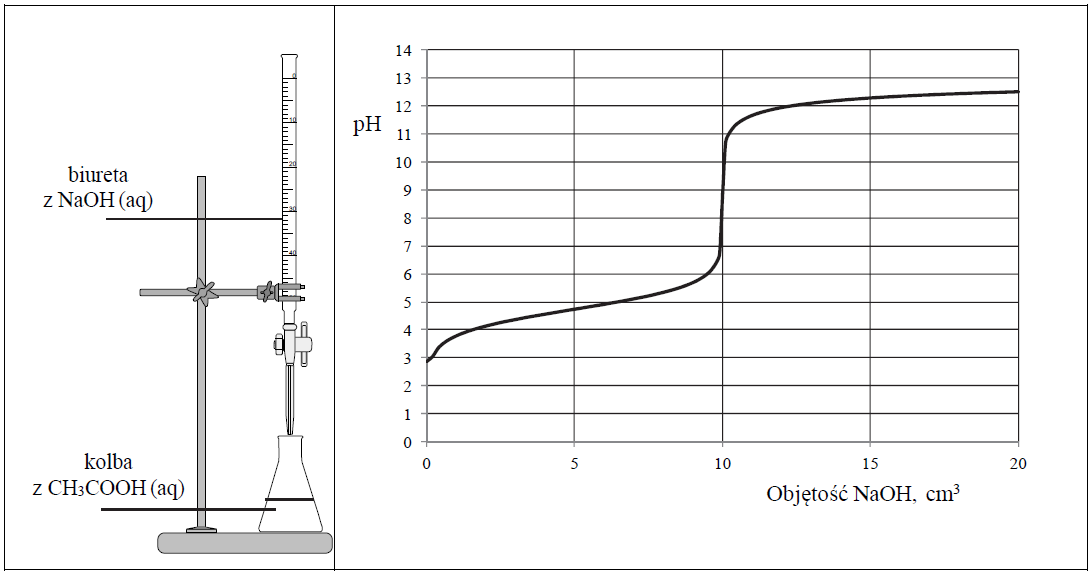
Po dodaniu takiej objętości roztworu wodorotlenku sodu, w jakiej znajdowała się liczba moli NaOH równa liczbie moli CH3COOH w roztworze wziętym do analizy, w układzie został osiągnięty punkt równoważnikowy. Ustalono, że w opisanym doświadczeniu pH w punkcie równoważnikowym było równe 9.
Podczas miareczkowania kwas–zasada zamiast pehametru można stosować wskaźniki pH. Muszą one być tak dobrane, aby zakres zmiany barwy wskaźnika przypadał w pobliżu punktu równoważnikowego miareczkowania.
Właściwości wybranych wskaźników oznaczonych numerami I, II, III i IV przedstawiono w poniższej tabeli.
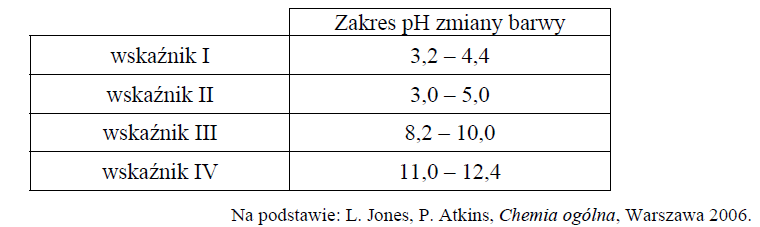
Spośród wskaźników podanych w tabeli i oznaczonych numerami I, II, III i IV wybierz i podaj numer tego wskaźnika, który powinien zostać użyty podczas opisanego miareczkowania roztworu kwasu etanowego.
Określenie odczynu roztworu w punkcie równoważnikowym miareczkowania. Zadanie 12. Arkusz CKE chemia maj 2018 rozszerzony (1 punkt)
Do wodnego roztworu kwasu etanowego (octowego) o określonej objętości, ale o nieznanym stężeniu, dodawano kroplami wodny roztwór wodorotlenku sodu o znanym stężeniu i za pomocą pehametru mierzono pH mieszaniny reakcyjnej. W ten sposób przeprowadzono tzw. miareczkowanie pehametryczne, które jest jedną z metod analizy ilościowej. W czasie doświadczenia zachodziła reakcja opisana równaniem:
CH3COOH + NaOH → CH3COONa + H2O
Zestaw użyty w tym doświadczeniu przedstawiono na poniższym schemacie, a otrzymane wyniki miareczkowania umieszczono na wykresie.

Po dodaniu takiej objętości roztworu wodorotlenku sodu, w jakiej znajdowała się liczba moli NaOH równa liczbie moli CH3COOH w roztworze wziętym do analizy, w układzie został osiągnięty punkt równoważnikowy. Ustalono, że w opisanym doświadczeniu pH w punkcie równoważnikowym było równe 9.
Uzupełnij poniższe zdanie – wybierz i podkreśl jedno określenie spośród podanych w nawiasie. Odpowiedź uzasadnij, odwołując się do procesu zachodzącego w roztworze. W opisanym doświadczeniu odczyn roztworu w punkcie równoważnikowym jest (kwasowy / obojętny / zasadowy). Uzasadnienie:

