Wskazanie różnicy w budowie cząsteczek D-glukozy i D-tagatozy dzięki której można odróżnić oba cukry określoną metodą. Zadanie 31.3. Arkusz CKE chemia maj 2019 rozszerzony (1 punkt)
Ketony, których cząsteczki zawierają grupę hydroksylową –OH przy atomie węgla połączonym z atomem węgla grupy karbonylowej (α-hydroksyketony), w wodnym roztworze o odczynie zasadowym ulegają izomeryzacji. Tę przemianę ilustruje poniższy schemat.
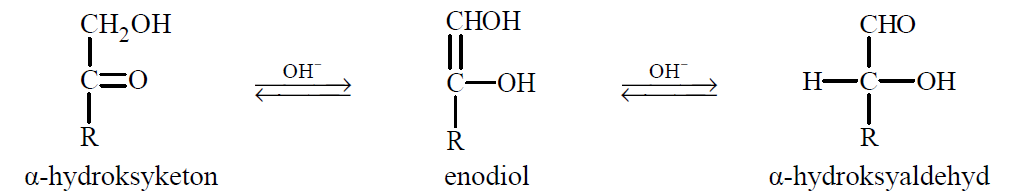
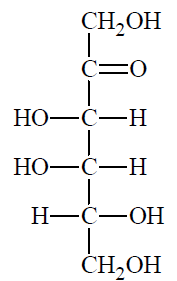
D-tagatoza jest monosacharydem o wzorze
W celu odróżnienia D-glukozy od D-tagatozy wybrano jeden odczynnik i przeprowadzono doświadczenie według schematu:
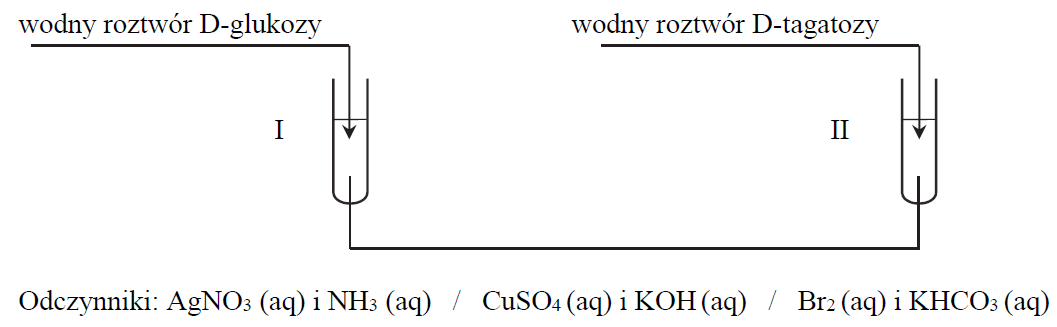
Wskaż różnicę w budowie cząsteczek D-glukozy i D-tagatozy umożliwiającą odróżnienie ich zaproponowaną metodą.
Wybór poprawnych określeń dotyczących ciągu przemian od glukozy do kwasu askorbinowego. Zadanie 32. Arkusz CKE chemia maj 2019 rozszerzony (1 punkt)
Kwas L-askorbinowy, zwany witaminą C, może być otrzymywany z glukozy w czteroetapowym procesie (I, II, III i IV) zgodnie z poniższym schematem.
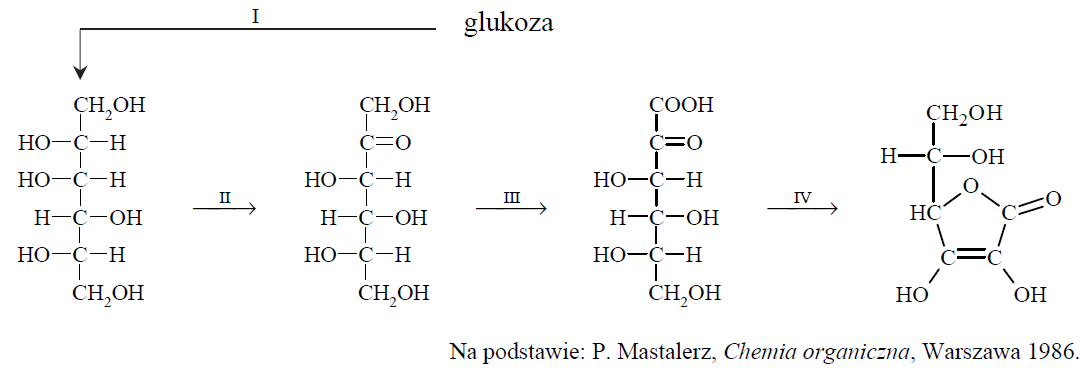
Uzupełnij poniższe zdania. Wybierz i zaznacz jedno określenie spośród podanych w każdym nawiasie. 1. Glukoza w etapie I jest (redukowana / utleniana) do związku o nazwie sorbitol. 2. W etapie II sorbitol jest (redukowany / utleniany) biotechnologicznie przez mikroorganizmy. 3. Podczas etapu III następuje zmiana stopnia utlenienia tylko jednego atomu węgla. W tej przemianie stopień utlenienia atomu węgla (maleje / rośnie). 4. Podczas etapu IV, w którym powstaje kwas askorbinowy, zachodzi m.in. reakcja (estryfikacji wewnątrzcząsteczkowej / hydrolizy / polimeryzacji).
Obliczanie wydajności całkowitej wieloetapowego procesu. Zadanie 33. Arkusz CKE chemia maj 2019 rozszerzony (1 punkt)
Witaminę C otrzymano w czteroetapowym procesie. Poszczególne etapy miały wydajność: WI = 92,0%, WII = 91,0%, WIII = 92,0% i WIV = 91,0%.
Na podstawie: J. McMurry, Chemia organiczna, Warszawa 2005.
Wybierz i zaznacz poprawne dokończenie zdania. Całkowita wydajność procesu otrzymywania witaminy C była równa A. 91,5% B. 90,0% C. 80,0% D. 70,1%
Wskazanie roli jodu w reakcji redoks z udziałem kwasu askorbinowego. Zadanie 34. Arkusz CKE chemia maj 2019 rozszerzony (1 punkt)
Zawartość kwasu askorbinowego w próbce wyznacza się na podstawie stechiometrii jego reakcji z jodem. Do roztworu zawierającego nieznaną ilość kwasu askorbinowego i niewielką ilość skrobi dodaje się kroplami roztwór jodu w roztworze jodku potasu. Stężenie roztworu jodu musi być dokładnie znane, a jego objętość – mierzona. Mówimy, że roztwór kwasu askorbinowego miareczkuje się roztworem jodu. Dopóki kwas askorbinowy jest obecny w roztworze, zachodzi reakcja, którą można w uproszczeniu opisać równaniem:
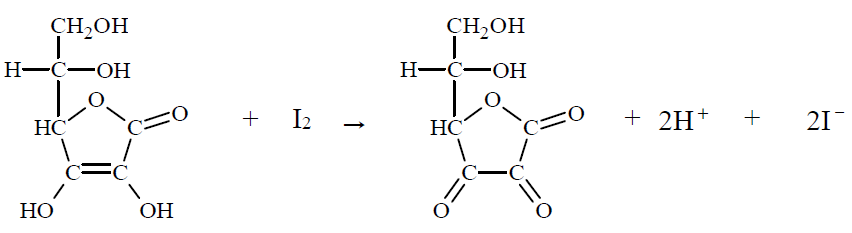
Gdy cały kwas askorbinowy przereaguje, jod dostarczony w nadmiarowej kropli poskutkuje zabarwieniem skrobi. W tym momencie kończy się miareczkowanie, co oznacza, że osiągnięto punkt końcowy i należy odczytać objętość zużytego roztworu jodu. Gdy zna się jego stężenie, można obliczyć, ile kwasu askorbinowego zawierała próbka.
Podaj, jaką funkcję (utleniacza czy reduktora) pełni jod w reakcji z kwasem askorbinowym. Napisz, na jaki kolor zabarwi się mieszanina reakcyjna w punkcie końcowym miareczkowania. Jod w reakcji z kwasem pełni funkcję: Pod wpływem jodu skrobia zabarwi się na:
Opis barwnych zmian zarejestrowanych podczas doświadczenia z udziałem kwasu solnego i roztworu manganianu(VII) potasu. Zadanie 36.1. Arkusz CKE chemia maj 2019 rozszerzony (1 punkt)
W laboratorium pod wyciągiem przeprowadzono reakcję manganianu(VII) potasu z nadmiarem kwasu solnego. Do wykrycia gazowego produktu zastosowano papierek jodoskrobiowy zwilżony wodą. Przebieg doświadczenia zilustrowano na poniższym schemacie.
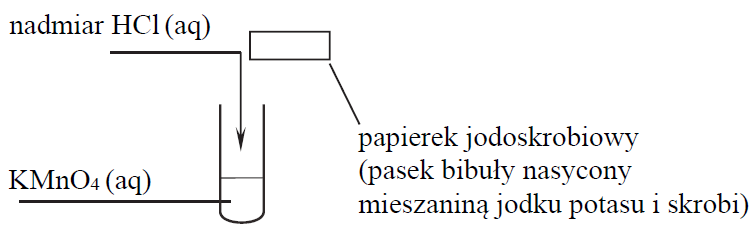
Opisz zmiany możliwe do zaobserwowania podczas przebiegu doświadczenia. Uzupełnij poniższą tabelę.
Wyjaśnienie przyczyny zmiany barwy papierka jodoskrobiowego podczas doświadczenia. Zadanie 36.2. Arkusz CKE chemia maj 2019 rozszerzony (1 punkt)
W laboratorium pod wyciągiem przeprowadzono reakcję manganianu(VII) potasu z nadmiarem kwasu solnego. Do wykrycia gazowego produktu zastosowano papierek jodoskrobiowy zwilżony wodą. Przebieg doświadczenia zilustrowano na poniższym schemacie.

Wyjaśnij przyczynę zmiany barwy papierka jodoskrobiowego.
Uzupełnienie schematu doświadczenia odpowiednim odczynnikiem potwierdzającym obecność określonych substancji. Zadanie 37.1. Arkusz CKE chemia maj 2019 rozszerzony (1 punkt)
Wykonano doświadczenie, w którym do probówki I wprowadzono wodny roztwór mocznika CO(NH2)2, a do probówki II – wodny roztwór węglanu amonu (NH4)2CO3. Następnie do obu probówek dodano ten sam odczynnik, który umożliwił potwierdzenie zawartości obu probówek. Wybrano jeden odczynnik spośród:
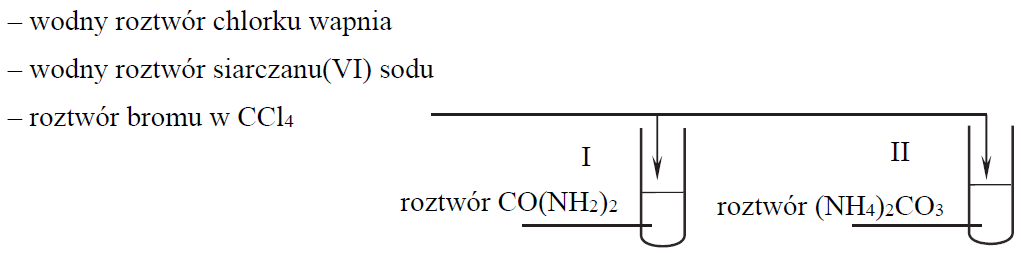
Uzupełnij schemat doświadczenia. Podkreśl nazwę odczynnika, który – po dodaniu do probówek z roztworami opisanych związków i wymieszaniu ich zawartości – umożliwi zaobserwowanie różnic w przebiegu doświadczenia z udziałem mocznika i węglanu amonu.
Zapis obserwacji podczas doświadczenia z udziałem roztworu mocznika oraz roztworu węglanu amonu. Zadanie 37.2. Arkusz CKE chemia maj 2019 rozszerzony (1 punkt)
Wykonano doświadczenie, w którym do probówki I wprowadzono wodny roztwór mocznika CO(NH2)2, a do probówki II – wodny roztwór węglanu amonu (NH4)2CO3. Następnie do obu probówek dodano ten sam odczynnik, który umożliwił potwierdzenie zawartości obu probówek. Wybrano jeden odczynnik spośród:

Napisz, jakie obserwacje potwierdzą, że w probówce I znajduje się wodny roztwór mocznika, a w probówce II – wodny roztwór węglanu amonu. Probówka I: Probówka II:
Rysowanie wzoru półstrukturalnego kwasu karboksylowego oraz nazwy jego bromopochodnej. Zadanie 38. Arkusz CKE chemia maj 2019 rozszerzony (1 punkt)
Aminokwasy białkowe są α-aminokwasami, co znaczy, że w ich cząsteczkach jedna para grup funkcyjnych: aminowej i karboksylowej, jest połączona z tym samym atomem węgla.
α-Aminokwasy można otrzymać z kwasów karboksylowych w syntezie, której przebieg zilustrowano na schemacie.
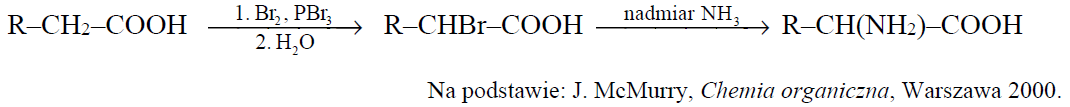
Napisz wzór półstrukturalny (grupowy) kwasu karboksylowego, którego należy użyć do otrzymania leucyny opisaną metodą, i podaj nazwę systematyczną bromopochodnej tego kwasu stanowiącej produkt pośredni w opisanej metodzie. Wzór półstrukturalny kwasu: Nazwa systematyczna bromopochodnej:
Wybór nazwy kwasu karboksylowego z którego powstał określony laktam. Zadanie 39. Arkusz CKE chemia maj 2019 rozszerzony (1 punkt)
Laktamy to związki, które powstają w wyniku wewnątrzcząsteczkowej kondensacji niektórych aminokwasów. W reakcji biorą udział: grupa karboksylowa i grupa aminowa znajdująca się np. przy 4., 5. lub 6. atomie węgla łańcucha aminokwasu. Przykładem laktamu jest związek o wzorze
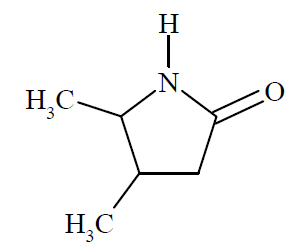
Spośród poniższych nazw wybierz nazwę aminokwasu, z którego otrzymano laktam o podanym wzorze. Zaznacz wybraną odpowiedź. A. kwas 2-amino-4-metylopentanowy B. kwas 4-amino-3,4-dimetylobutanowy C. kwas 4-amino-3-metylopentanowy D. kwas 4-metylo-4-aminopentanowy
Rysowanie wzoru grupowego tripeptydu na podstawie znajomości sekwencji jego aminokwasów. Zadanie 40. Arkusz CKE chemia maj 2019 rozszerzony (1 punkt)
Poniżej przedstawiono sekwencję aminokwasów pewnego tripeptydu:
Phe-Gly-Cys
Napisz wzór półstrukturalny (grupowy) tego tripeptydu. Pamiętaj, że w zastosowanej notacji umieszcza się z lewej strony kod aminokwasu, którego reszta zawiera wolną grupę aminową połączoną z atomem węgla α.



