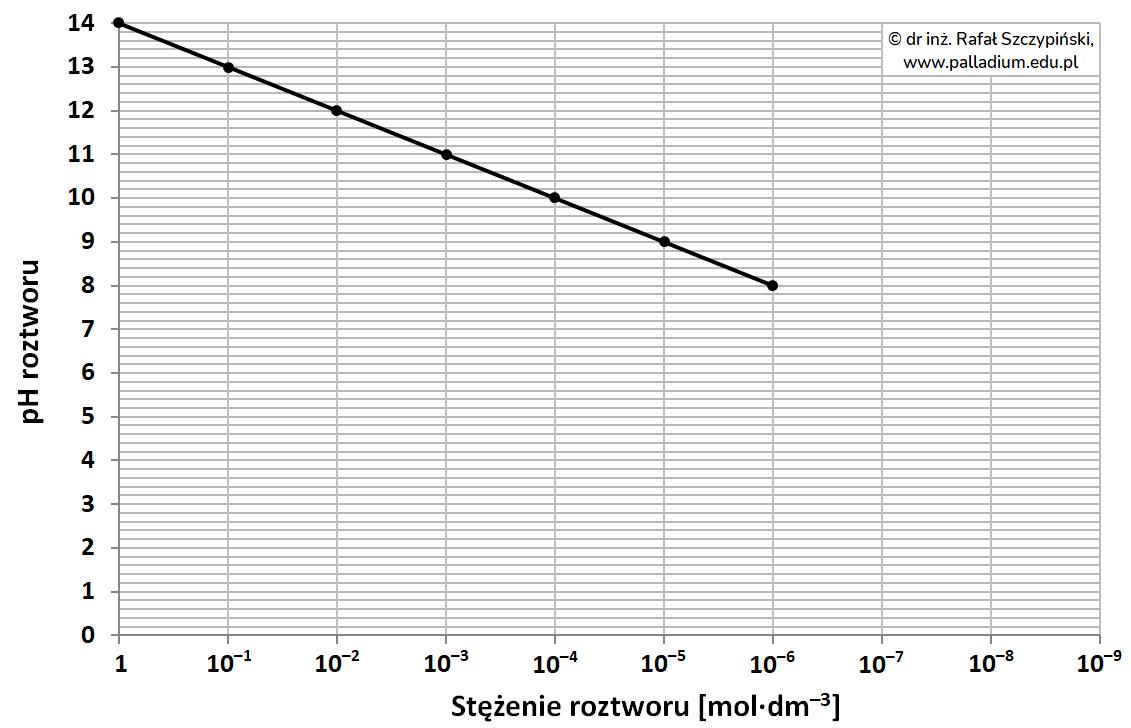
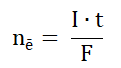W nieodwracalnym ogniwie litowo-chromianowym, elektrolitem jest chloran(VII) litu rozpuszczony w pewnym cyklicznym estrze kwasu węglowego. Anodę stanowi lit, natomiast katodą jest srebro pokryte chromianem(VI) srebra. Gdy jony Ag+ wchodzące w skład pokrywającej srebro soli ulegają redukcji w trakcie pracy ogniwa, masa katody ulega zmniejszeniu, ponieważ powstający wówczas chromian(VI) litu stosunkowo dobrze rozpuszcza się w elektrolicie. Z uwagi na niewielkie przewodnictwo roztworu, opisane ogniwo można stosować jedynie wtedy, gdy jego obciążenie w trakcie pracy (płynący prąd elektryczny) jest bardzo małe, dlatego zwykle wykorzystywane jest w układach zasilających rozruszniki serca. Liczba moli elektronów redukujących kationy pierwiastka metalicznego w trakcie pracy ogniwa zasilającego takie urządzenie prądem o natężeniu I (ampery) w czasie t (sekundy) może być wyrażona wzorem, w którym F jest stałą Faradaya (96500 C∙mol–1):
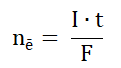
Zmiana masy elektrody wynikająca z pracy ogniwa jest wtedy wprost proporcjonalna do masy wydzielonego pierwiastka chemicznego na tej elektrodzie.
Na podstawie: K.-H. Lautenschlӓger, W. Schrӧter, A. Wanninger, Nowoczesne kompendium chemii, Warszawa 2018 oraz P. Atkins, L. Jones, Chemia ogólna. Cząsteczki, materia, reakcje, Warszawa 2018.
Masa jednego mola cząsteczek opisanego cyklicznego estru wynosi 102 g, a stosunek masowy węgla do tlenu równy jest w nim 1:1, przy czym pierwiastki te stanowią razem 94,12% masy opisanej substancji. Związek ten zawiera dwa wiązania estrowe i jest pochodną takiego alkoholu, który po wprowadzeniu do świeżo przygotowanej alkalicznej zawiesiny wodorotlenku miedzi(II) i energicznym wstrząśnięciu zawartością naczynia daje efekt widoczny na fotografii.

Oceń, czy opisany ester występuje w postaci diastereoizomerów. Uzasadnij odpowiedź.
Ocena:
Uzasadnienie:
© dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone