Zapis wzoru sumarycznego katalizatora oraz rozstrzygnięcie czy opisany proces to reakcja autokatalityczna. Zadanie 20.3. Arkusz CKE chemia maj 2024 rozszerzony (1 punkt)
Przemiany katalizowane przez jeden z produktów są nazywane reakcjami autokatalitycznymi.
Reakcja jodowania acetonu, prowadzona w roztworze wodnym w obecności jonów hydroniowych, przebiega w dwóch etapach:
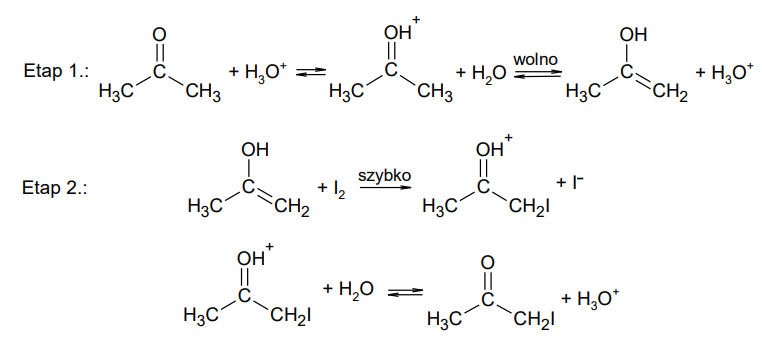
W etapie 1. zachodzą powolne przemiany prowadzące do powstania enolu. Etap 2. to szybka reakcja enolu z jodem, której produkt przekształca się w jodoaceton.
Napisz wzór drobiny, która pełni funkcję katalizatora w reakcji jodowania acetonu. Rozstrzygnij, czy reakcja jodowania acetonu jest zaliczana do reakcji autokatalitycznych. Katalizator Rozstrzygnięcie:
Wybór najmocniejszego kwasu oraz uzasadnienie dlaczego jest to kwas najmocniejszy z podanych. Zadanie 21.1. Arkusz CKE chemia maj 2024 rozszerzony (2 punkty)
Przygotowano próbki czterech kwasów:
– CH3COOH
– CH2ClCOOH
– CHCl2COOH
– CCl3COOH
Wszystkie roztwory miały jednakową objętość. Stężenie molowe każdego kwasu było równe 1 mol∙dm–3. Do roztworów tych kwasów, znajdujących się w probówkach w przypadkowej kolejności, dodano po pięć kropli roztworu fioletu metylowego, który jest wskaźnikiem pH. Wyniki doświadczenia przedstawiono na zdjęciach.

Fragment skali barw dla fioletu metylowego w roztworach o różnym pH przedstawia poniższy rysunek.
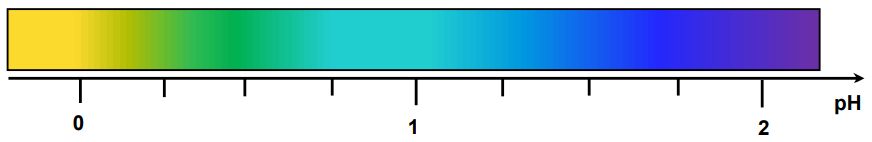
Wartości pKa dla kwasów użytych w doświadczeniu, podane w przypadkowej kolejności, wynoszą: 2,87; 4,76; 0,66; 1,35.
Na podstawie informacji wstępnej wybierz probówkę, w której znajduje się roztwór najmocniejszego kwasu, i dokończ zdania. Roztwór najmocniejszego kwasu znajduje się w probówce oznaczonej literą: Wzór półstrukturalny (grupowy) tego kwasu to: Wyjaśnij, dlaczego wybrany kwas wykazuje największą moc. W wyjaśnieniu odwołaj się do budowy cząsteczek tego związku. Wyjaśnienie:
Rysowanie wzoru grupowego najsłabszego kwasu ze wskazaniem wartości jego pKa. Zadanie 21.2. Arkusz CKE chemia maj 2024 rozszerzony (1 punkt)
Przygotowano próbki czterech kwasów:
– CH3COOH
– CH2ClCOOH
– CHCl2COOH
– CCl3COOH
Wszystkie roztwory miały jednakową objętość. Stężenie molowe każdego kwasu było równe 1 mol∙dm–3. Do roztworów tych kwasów, znajdujących się w probówkach w przypadkowej kolejności, dodano po pięć kropli roztworu fioletu metylowego, który jest wskaźnikiem pH. Wyniki doświadczenia przedstawiono na zdjęciach.

Fragment skali barw dla fioletu metylowego w roztworach o różnym pH przedstawia poniższy rysunek.

Wartości pKa dla kwasów użytych w doświadczeniu, podane w przypadkowej kolejności, wynoszą: 2,87; 4,76; 0,66; 1,35.
Uzupełnij tabelę. Napisz wzór półstrukturalny (grupowy) najsłabszego kwasu użytego w tym doświadczeniu oraz wartość pKa tego kwasu.
Zapis równania reakcji otrzymywania chlorku benzoilu. Zadanie 22. Arkusz CKE chemia maj 2024 rozszerzony (1 punkt)
Chlorki kwasowe otrzymuje się przez podstawienie grupy –OH kwasu karboksylowego atomem chloru. Zazwyczaj stosuje się w tym celu chlorek tionylu o wzorze SOCl2, ponieważ produkty nieorganiczne – tlenek siarki(IV) oraz chlorowodór – są gazami i można je łatwo oddzielić od produktu organicznego.
Chlorki kwasowe to bardzo reaktywne pochodne kwasów karboksylowych. Ich reakcje z alkoholami przebiegają szybko i praktycznie nieodwracalnie. Ten proces można zilustrować równaniem:
R1COCl + R2–OH → R1COOR2 + HCl
Na podstawie: R.T. Morrison, R.N. Boyd, Chemia organiczna, Warszawa 2011.
Napisz równanie reakcji otrzymywania chlorku benzoilu opisaną metodą. Zastosuj wzór półstrukturalny (grupowy) lub uproszczony odpowiedniego kwasu karboksylowego.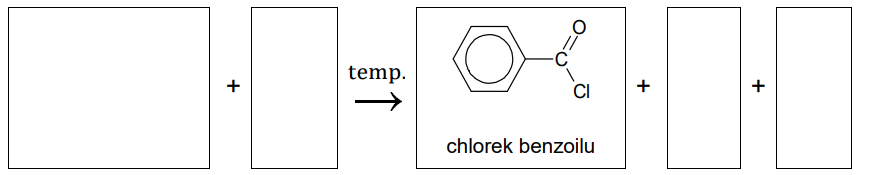
Wyjaśnienie przyczyny przebiegu reakcji z większą wydajnością w porównaniu z inną metodą otrzymywania estru. Zadanie 23. Arkusz CKE chemia maj 2024 rozszerzony (1 punkt)
Chlorki kwasowe otrzymuje się przez podstawienie grupy –OH kwasu karboksylowego atomem chloru. Zazwyczaj stosuje się w tym celu chlorek tionylu o wzorze SOCl2, ponieważ produkty nieorganiczne – tlenek siarki(IV) oraz chlorowodór – są gazami i można je łatwo oddzielić od produktu organicznego.
Chlorki kwasowe to bardzo reaktywne pochodne kwasów karboksylowych. Ich reakcje z alkoholami przebiegają szybko i praktycznie nieodwracalnie. Ten proces można zilustrować równaniem:
R1COCl + R2–OH → R1COOR2 + HCl
Na podstawie: R.T. Morrison, R.N. Boyd, Chemia organiczna, Warszawa 2011.
Wyjaśnij, dlaczego reakcja powstawania estru z chlorku kwasowego i alkoholu zachodzi z większą wydajnością niż reakcja otrzymywania identycznego estru z kwasu karboksylowego i alkoholu w obecności H2SO4. W odpowiedzi porównaj przebieg obu reakcji.
Rysowanie wzorów półstrukturalnych związków chemicznych. Zadanie 24.1. Arkusz CKE chemia maj 2024 rozszerzony (2 punkty)
Na poniższym schemacie przedstawiono ciąg przemian związków organicznych A, B i C:
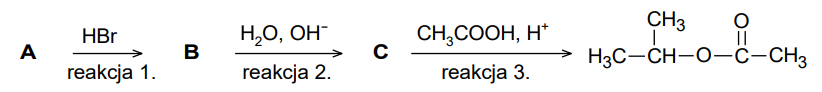
Napisz wzory półstrukturalne (grupowe) związków oznaczonych na schemacie literami A, B i C. Związek A: Związek B: Związek C:
Określanie typów oraz mechanizmów reakcji chemicznych. Zadanie 24.2. Arkusz CKE chemia maj 2024 rozszerzony (2 punkty)
Na poniższym schemacie przedstawiono ciąg przemian związków organicznych A, B i C:
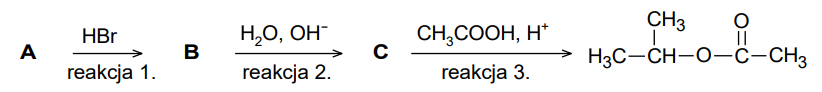
Określ typ reakcji (addycja, eliminacja, substytucja) oraz mechanizm (elektrofilowy, nukleofilowy, rodnikowy) reakcji oznaczonych na schemacie numerami 1. i 2.
Określanie wzoru elementarnego, rzeczywistego, wzorów półstrukturalnych oraz zapis równania reakcji chemicznej. Zadanie 25. Arkusz CKE chemia maj 2024 rozszerzony (4 punkty) zadanie problemowe
Trzy związki organiczne X, Y i Q są izomerami o masie molowej równej 90 g∙mol–1. W wyniku spalenia 45 mg jednego z tych związków otrzymano 27 mg wody oraz 36,0 cm3 tlenku węgla(IV) odmierzonego w temperaturze 293 K i pod ciśnieniem 1013 hPa. O cząsteczkach tych związków wiadomo, że:
– szkielet każdej z cząsteczek stanowią połączone atomy węgla
– cząsteczki związków X i Y są chiralne, a związku Q – achiralne
– cząsteczki związków Y i Q mają takie same grupy funkcyjne
– odczyn wodnego roztworu związku X jest obojętny, a odczyn wodnego roztworu związku Y – kwasowy.
Przeprowadzono następujące doświadczenie: do próbki związku X wprowadzono zawiesinę świeżo strąconego Cu(OH)2, wymieszano (na zimno), a następnie ogrzano. Wyniki tego eksperymentu zilustrowano na poniższych zdjęciach.

Na podstawie obliczeń ustal wzór elementarny i rzeczywisty (sumaryczny) opisanych związków. Następnie napisz: – wzory półstrukturalne (grupowe) związków X i Y – w formie cząsteczkowej równanie reakcji związku Q z wodorotlenkiem sodu. Zastosuj wzory półstrukturalne (grupowe) związków organicznych. Uniwersalna stała gazowa R = 83,14 hPa∙dm3∙mol–1∙K–1. Wzór elementarny związków: Wzór sumaryczny związków: Wzór półstrukturalny związku X: Wzór półstrukturalny związku Y: Równanie reakcji związku Q z wodorotlenkiem sodu:
Zapis równania reakcji chemicznej zgodnie z teorią Brønsteda. Zadanie 26. Arkusz CKE chemia maj 2024 rozszerzony (1 punkt)
Przeprowadzono reakcje zgodnie ze schematem:
Wpisz do schematu wzory odpowiednich drobin, tak aby powstało równanie reakcji 3. w formie jonowej skróconej. Zastosuj definicję kwasu i zasady Brønsteda.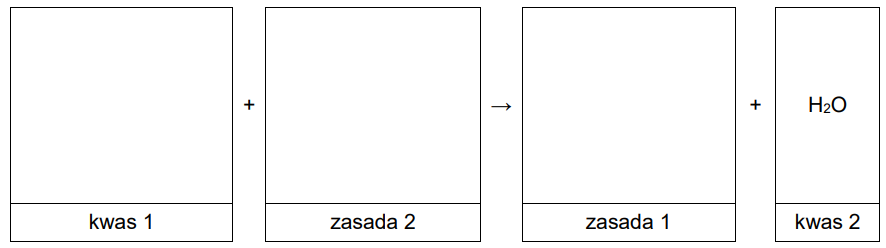
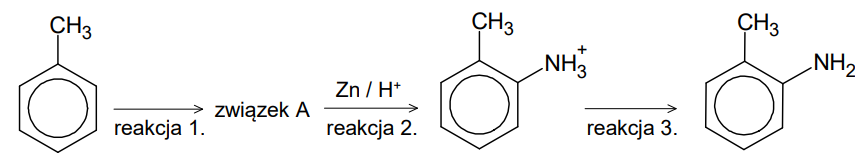
Zapis wzoru produktu reakcji oraz określenie czy jest to proces redoks. Zadanie 27. Arkusz CKE chemia maj 2024 rozszerzony (1 punkt)
Przeprowadzono reakcje zgodnie ze schematem:

Organiczny związek otrzymany w reakcji 3. zmieszano z bromem (w stosunku molowym 1 : 1) i poddano reakcji w obecności światła.
Narysuj wzór półstrukturalny lub uproszczony organicznego produktu opisanej reakcji i uzupełnij zdanie. Wybierz i zaznacz właściwą odpowiedź spośród podanych w nawiasie. Wzór produktu reakcji: Opisana przemiana (jest / nie jest) reakcją utlenienia-redukcji.
Zapis form fenyloalaniny występujących w danym środowisku. Zadanie 28. Arkusz CKE chemia maj 2024 rozszerzony (2 punkty)
Przeprowadzono doświadczenie zilustrowane na poniższym rysunku:
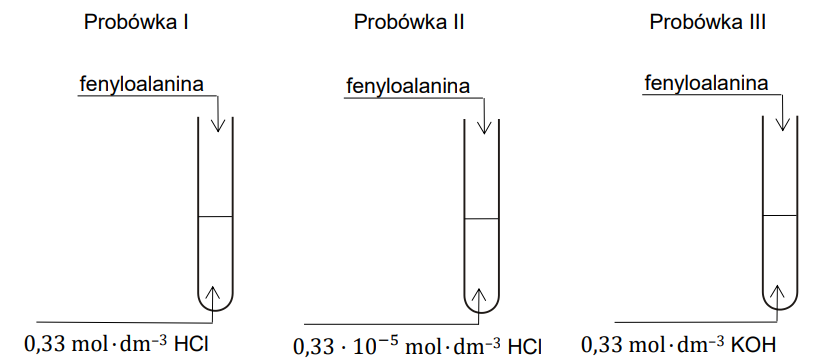
Uzupełnij poniższe schematy, tak aby powstały wzory półstrukturalne (grupowe) fenyloalaniny w postaci, w której ten aminokwas będzie występował w dominującej formie w roztworze w każdej probówce.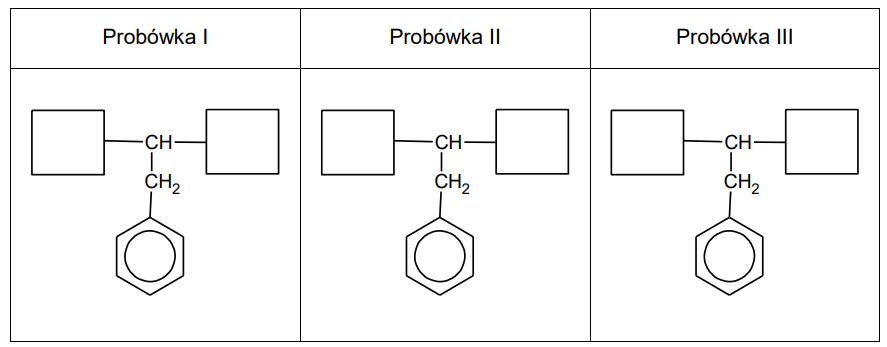
Rozstrzygnięcie, czy degradacja Ruffa D-mannozy prowadzi do otrzymania tej samej aldopentozy, co degradacja Ruffa D-glukozy. Zadanie 29. Arkusz CKE chemia maj 2024 rozszerzony (1 punkt)
Degradacja Ruffa to dwuetapowa reakcja, która pozwala na skrócenie łańcucha cząsteczki aldozy o jeden atom węgla. Pierwszy etap procesu to utlenienie aldozy do kwasu aldonowego za pomocą wody bromowej. W drugim etapie kwas aldonowy jest utleniany nadtlenkiem wodoru w obecności siarczanu(VI) żelaza(III), co prowadzi do otrzymania aldozy o krótszym łańcuchu węglowym i tlenku węgla(IV).
Na podstawie: R.T. Morrison, R.N. Boyd, Chemia organiczna, Warszawa 2011.
Poniżej przedstawiono schemat degradacji Ruffa, w której D-glukoza przekształca się w D-arabinozę:
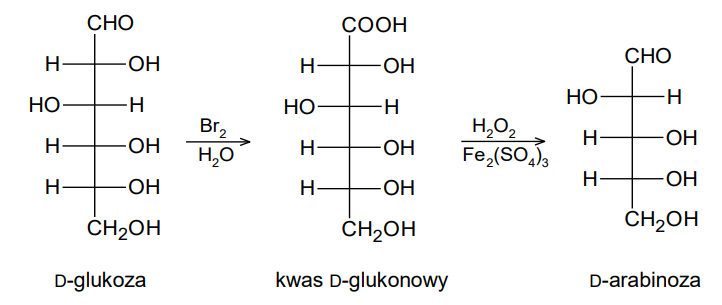
Rozstrzygnij, czy degradacja Ruffa D-mannozy prowadzi do otrzymania tej samej aldopentozy, co degradacja Ruffa D-glukozy. Odpowiedź uzasadnij. W uzasadnieniu porównaj budowę cząsteczek obu aldoheksoz. Wzór D-mannozy: Rozstrzygnięcie: Uzasadnienie: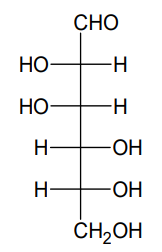
Wybór właściwego cukru użytego podczas reakcji chemicznej. Zadanie 30. Arkusz CKE chemia maj 2024 rozszerzony (1 punkt)
Degradacja Ruffa to dwuetapowa reakcja, która pozwala na skrócenie łańcucha cząsteczki aldozy o jeden atom węgla. Pierwszy etap procesu to utlenienie aldozy do kwasu aldonowego za pomocą wody bromowej. W drugim etapie kwas aldonowy jest utleniany nadtlenkiem wodoru w obecności siarczanu(VI) żelaza(III), co prowadzi do otrzymania aldozy o krótszym łańcuchu węglowym i tlenku węgla(IV).
Na podstawie: R.T. Morrison, R.N. Boyd, Chemia organiczna, Warszawa 2011.
Poniżej przedstawiono schemat degradacji Ruffa, w której D-glukoza przekształca się w D-arabinozę:

Degradacji Ruffa poddano jeden ze związków, których wzory przedstawiono poniżej. Powstały cukier utleniono kwasem azotowym(V) i otrzymano związek, którego cząsteczki są achiralne – kwas mezo-winowy.
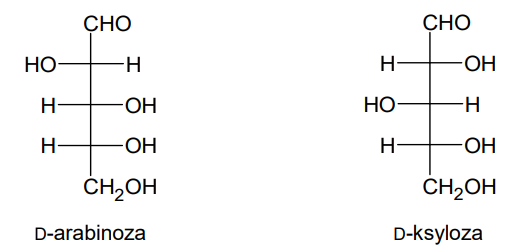
Wybierz cukier, którego użyto do przeprowadzenia opisanego doświadczenia, i napisz nazwę tego cukru.