Zapis równania procesu utleniania oraz sumarycznego równania reakcji chemicznej. Zadanie 11. Arkusz CKE chemia maj 2024 rozszerzony (2 punkty)
Jony FeO42– mogą powstać podczas reakcji Fe(OH)3 z jonami ClO– w nasyconym roztworze NaOH, zilustrowanej poniższym schematem:
Fe(OH)3 + ClO– + OH– → FeO42– + Cl– + H2O
Na podstawie: L. Kolditz, Chemia nieorganiczna, Warszawa 1994.
Napisz w formie jonowej skróconej z uwzględnieniem liczby oddawanych lub pobieranych elektronów (zapis jonowo-elektronowy) równanie reakcji utleniania zachodzącej podczas opisanej przemiany. Uwzględnij środowisko reakcji. Uzupełnij współczynniki stechiometryczne w poniższym schemacie. Równanie reakcji utleniania:![]()
Zapis według konwencji sztokholmskiej schematu ogniwa zbudowanego z półogniw redoks. Zadanie 12.1. Arkusz CKE chemia maj 2024 rozszerzony (1 punkt)
Poniżej przedstawiono równania reakcji, które przebiegają w wybranych półogniwach redoks.

W tych półogniwach elementem przewodzącym jest platyna – nie bierze ona udziału w reakcji elektrodowej.
Uzupełnij poniższy zapis, tak aby powstał schemat ogniwa galwanicznego zbudowanego z półogniw A i B, które generuje prąd w warunkach standardowych. Napisz, które półogniwo pełni funkcję anody, a które – katody w pracującym ogniwie.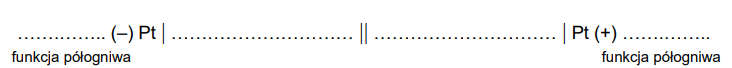
Zapis sumarycznego równania reakcji chemicznej przebiegającej w ogniwie zbudowanym z półogniw redoks. Zadanie 12.2. Arkusz CKE chemia maj 2024 rozszerzony (1 punkt)
Poniżej przedstawiono równania reakcji, które przebiegają w wybranych półogniwach redoks.

W tych półogniwach elementem przewodzącym jest platyna – nie bierze ona udziału w reakcji elektrodowej.
Napisz w formie jonowej sumaryczne równanie reakcji, która zachodzi w pracującym ogniwie zbudowanym z półogniw A i B.
Ocena poprawności zdań dotyczących reakcji równowagowej. Zadanie 13.1. Arkusz CKE chemia maj 2024 rozszerzony (1 punkt)
Stężeniowa stała równowagi reakcji zilustrowanej poniższym równaniem:
CO2 (g) + H2 (g) ⇄ CO (g) + H2O (g) ∆𝐻 > 0
w temperaturze T wynosi 1,0.
Oceń prawdziwość poniższych zdań. Zaznacz P, jeśli zdanie jest prawdziwe, albo F – jeśli jest fałszywe. 1. Zwiększenie ciśnienia w warunkach izotermicznych (T = const) w opisanym układzie będącym w stanie równowagi będzie skutkowało wzrostem wydajności reakcji otrzymywania tlenku węgla(II) i pary wodnej. 2. Obniżenie temperatury w warunkach izobarycznych (p = const) w opisanym układzie będącym w stanie równowagi będzie skutkowało zmniejszeniem wartości stałej równowagi reakcji otrzymywania tlenku węgla(II) i pary wodnej.
Obliczanie początkowych liczb moli tlenku węgla(IV) oraz wodoru w mieszaninie substratów. Zadanie 13.2. Arkusz CKE chemia maj 2024 rozszerzony (2 punkty)
Stężeniowa stała równowagi reakcji zilustrowanej poniższym równaniem:
CO2 (g) + H2 (g) ⇄ CO (g) + H2O (g) ∆𝐻 > 0
w temperaturze T wynosi 1,0.
W reaktorze o pojemności 1,0 dm3 zmieszano w temperaturze T tlenek węgla(IV) i wodór. Sumaryczna liczba moli tych reagentów była równa 10.
Oblicz początkową liczbę moli tlenku węgla(IV) i początkową liczbę moli wodoru w mieszaninie, jeżeli wiadomo, że do momentu ustalenia się stanu równowagi w temperaturze T przereagowało 60% wodoru.
Zapis nazwy systematycznej oraz wzoru grupowego. Zadanie 14. Arkusz CKE chemia maj 2024 rozszerzony (1 punkt)
Poniżej przedstawiono wzory półstrukturalne wybranych węglowodorów – związków X, Y i Q.
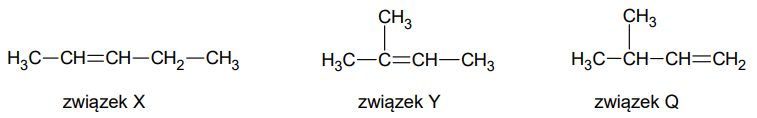
W reakcji związku X z bromowodorem powstaje mieszanina związków A i B. Ogrzewanie związku A w alkoholowym roztworze wodorotlenku potasu prowadzi do otrzymania związku X jako jedynego produktu organicznego reakcji eliminacji.
Napisz nazwę systematyczną związku A i narysuj wzór półstrukturalny (grupowy) związku B. Nazwa systematyczna związku A: Wzór związku B:
Rozstrzygnięcie wraz z uzasadnieniem dotyczące produktu reakcji addycji wody w środowisku kwasowym. Zadanie 15. Arkusz CKE chemia maj 2024 rozszerzony (1 punkt)
Poniżej przedstawiono wzory półstrukturalne wybranych węglowodorów – związków X, Y i Q.

Rozstrzygnij, czy główny produkt addycji wody do związku Y w obecności katalizatora H3O+ jest taki sam jak główny produkt addycji wody do związku Q prowadzonej w tych samych warunkach. Odpowiedź uzasadnij. W uzasadnieniu odnieś się do konsekwencji różnicy w budowie cząsteczek. Rozstrzygnięcie: Uzasadnienie:
Zapis nazwy systematycznej alkenu oraz wzoru grupowego ketonu powstałych w wyniku reakcji chemicznej. Zadanie 16.1. Arkusz CKE chemia maj 2024 rozszerzony (1 punkt)
Poniżej przedstawiono wzory półstrukturalne wybranych węglowodorów – związków X, Y i Q.

Utlenianie alkenów w zakwaszonym wodnym roztworze KMnO4 przebiega w podwyższonej temperaturze zgodnie ze schematem:
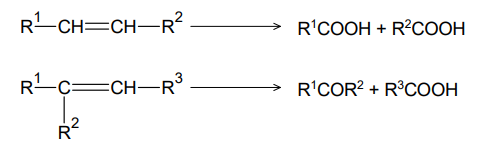
Jednym z produktów utleniania związku X, Y albo Q jest keton.
Napisz nazwę systematyczną alkenu, którego jednym z produktów utleniania jest keton, i narysuj wzór półstrukturalny (grupowy) tego ketonu. Nazwa systematyczna alkenu: Wzór ketonu:
Wybór związku chemicznego o większej wartości stałej dysocjacji oraz zapis wzoru produktu jego reakcji z KOH. Zadanie 16.2. Arkusz CKE chemia maj 2024 rozszerzony (1 punkt)
Poniżej przedstawiono wzory półstrukturalne wybranych węglowodorów – związków X, Y i Q.

Utlenianie alkenów w zakwaszonym wodnym roztworze KMnO4 przebiega w podwyższonej temperaturze zgodnie ze schematem:

W reakcji utleniania węglowodoru X powstają dwa związki organiczne różniące się wartością stałej dysocjacji Ka.
Wybierz związek, który ma wyższą wartość stałej dysocjacji Ka, i napisz wzór półstrukturalny (grupowy) organicznego produktu reakcji tego związku z wodorotlenkiem potasu.
Zapis wzoru sumarycznego oraz wzoru grupowego produktów reakcji chemicznej. Zadanie 17.1. Arkusz CKE chemia maj 2024 rozszerzony (1 punkt)
Cykloalkany ulegają analogicznym reakcjom jak alkany.
Benzen, cykloheksan i styren to węglowodory, które w temperaturze pokojowej są bezbarwnymi cieczami. Ich wzory przedstawiono poniżej:
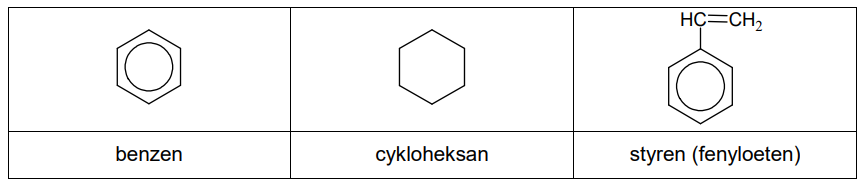
W trzech naczyniach znajdowały się oddzielnie i w przypadkowej kolejności: benzen, cykloheksan i styren. W celu identyfikacji tych substancji wykonano dwuetapowe doświadczenie. W pierwszym etapie do trzech probówek zawierających wodny roztwór manganianu(VII) potasu w środowisku obojętnym wprowadzono po jednej z badanych substancji. Następnie każdą probówkę zamknięto korkiem i wstrząśnięto. Po pewnym czasie zawartości probówek przybrały wygląd pokazany na zdjęciach.

W pierwszym etapie zidentyfikowano jeden z trzech węglowodorów. W drugim etapie doświadczenia do próbek niezidentyfikowanych węglowodorów wprowadzono stężony kwas azotowy(V) z dodatkiem stężonego kwasu siarkowego(VI) – i ogrzano zawartości probówek. Wyniki drugiego etapu doświadczenia przedstawiono na poniższych zdjęciach.

Napisz wzór sumaryczny związku manganu, który powstał w wyniku reakcji zachodzącej w pierwszym etapie doświadczenia, oraz wzór półstrukturalny (grupowy) lub uproszczony organicznego produktu tej przemiany. Wzór związku manganu: Wzór produktu organicznego:
Zapis równania reakcji spalania PVC. Zadanie 18. Arkusz CKE chemia maj 2024 rozszerzony (1 punkt)
Na poniższym schemacie zilustrowano dwuetapowy proces otrzymywania PVC – poli(chlorku winylu) – z acetylenu (etynu).
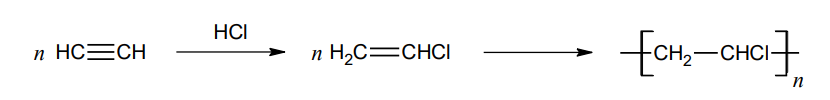
Etyn stosowany w tej reakcji powstaje w wyniku działania wody na acetylenek wapnia, stanowiący główny składnik karbidu.
Podczas spalania PVC powstają tlenek węgla(IV), para wodna i bezbarwny gaz o ostrym zapachu, którego cząsteczki są zbudowane z dwóch atomów. Stosunek molowy produktów spalania jest równy 𝑛CO2 ∶ 𝑛H2O ∶ 𝑛X = 2 : 1 : 1.
Uzupełnij poniższy schemat, tak aby otrzymać równanie reakcji spalania, w której uczestniczy fragment PVC zbudowany z czterech merów.
Obliczanie masy zanieczyszczonego karbidu niezbędnej do otrzymania PVC. Zadanie 19. Arkusz CKE chemia maj 2024 rozszerzony (2 punkty)
Na poniższym schemacie zilustrowano dwuetapowy proces otrzymywania PVC – poli(chlorku winylu) – z acetylenu (etynu).
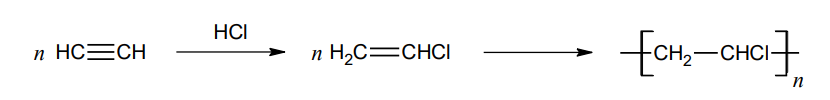
Etyn stosowany w tej reakcji powstaje w wyniku działania wody na acetylenek wapnia, stanowiący główny składnik karbidu.
Reakcja acetylenku wapnia CaC2 z wodą przebiega według równania:
CaC2 + 2H2O → C2H2 + Ca(OH)2
Oblicz, ile gramów karbidu, zawierającego 82 % CaC2, potrzeba do otrzymania 100 g PVC. Całkowita wydajność procesu jest równa 78%.
Wskazanie numeru etapu decydującego o szybkości całego procesu. Zadanie 20.1. Arkusz CKE chemia maj 2024 rozszerzony (1 punkt)
Przemiany katalizowane przez jeden z produktów są nazywane reakcjami autokatalitycznymi.
Reakcja jodowania acetonu, prowadzona w roztworze wodnym w obecności jonów hydroniowych, przebiega w dwóch etapach:
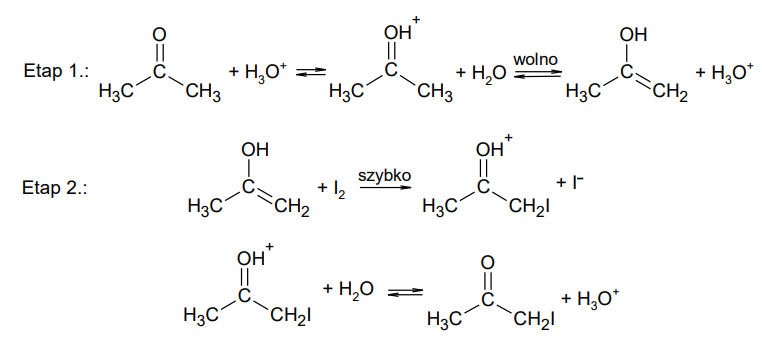
W etapie 1. zachodzą powolne przemiany prowadzące do powstania enolu. Etap 2. to szybka reakcja enolu z jodem, której produkt przekształca się w jodoaceton.
Napisz, który etap: 1. czy 2., opisanego mechanizmu jodowania acetonu, decyduje o szybkości powstawania produktu. Wpisz właściwy numer poniżej.
Zapis sumarycznego równania reakcji jodowania acetonu. Zadanie 20.2. Arkusz CKE chemia maj 2024 rozszerzony (1 punkt)
Przemiany katalizowane przez jeden z produktów są nazywane reakcjami autokatalitycznymi.
Reakcja jodowania acetonu, prowadzona w roztworze wodnym w obecności jonów hydroniowych, przebiega w dwóch etapach:

W etapie 1. zachodzą powolne przemiany prowadzące do powstania enolu. Etap 2. to szybka reakcja enolu z jodem, której produkt przekształca się w jodoaceton.
Napisz w formie jonowej sumaryczne równanie reakcji jodowania acetonu. Zastosuj wzory półstrukturalne (grupowe) związków organicznych.