Wskazanie typu oraz mechanizmu reakcji chemicznej. Zadanie 24. Arkusz CKE chemia maj 2023 rozszerzony (1 punkt)
Na poniższym schemacie zilustrowano ciąg przemian chemicznych. Literami X oraz Y oznaczono produkty organiczne kolejnych przemian.

Uzupełnij poniższe zdanie. Wybierz i zaznacz jedno określenie spośród podanych w każdym nawiasie. Organiczny produkt reakcji 3. powstaje w procesie (substytucji / addycji / eliminacji) zachodzącym według mechanizmu (rodnikowego / elektrofilowego / nukleofilowego).
Wybór wzoru związku chemicznego którego cząsteczki są chiralne z uzasadnieniem. Zadanie 25. Arkusz CKE chemia maj 2023 rozszerzony (1 punkt)
Poniżej podano wzory półstrukturalne (grupowe) trzech związków organicznych.
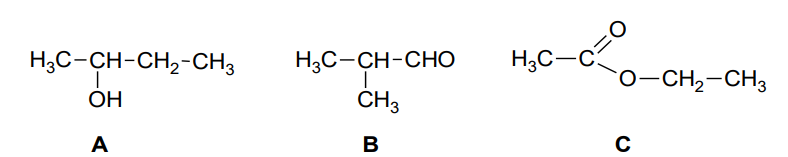
Wybierz związek (A, B albo C), którego cząsteczki są chiralne, i napisz literę, którą oznaczono jego wzór. Uzasadnij swój wybór – odwołaj się do budowy cząsteczek tego związku. Związek: Uzasadnienie:
Rysowanie wzorów grupowych związków chemicznych spełniających określone kryteria. Zadanie 26. Arkusz CKE chemia maj 2023 rozszerzony (2 punkty)
Poniżej podano wzory półstrukturalne (grupowe) trzech związków organicznych.

Każdy ze związków A, B, C ma izomery. Poniżej opisano trzy z nich – oznaczone odpowiednio jako związki A1, B1, C1.
• Związek A1 to izomer związku A, który można utlenić do związku B.
• Związek B1 to izomer związku B, który można zredukować do związku A.
• Związek C1 to izomer związku C, który można otrzymać przez utlenienie związku B.
Narysuj wzory półstrukturalne (grupowe) związków A1, B1 i C1. A1: B1: C1:
Wskazanie stopnia utlenienia oraz typu hybrydyzacji atomów węgla. Zadanie 27.1. Arkusz CKE chemia maj 2023 rozszerzony (2 punkty)
Poniżej przedstawiono wzory półstrukturalne (grupowe) dwóch związków zapachowych: geranialu oraz geraniolu.
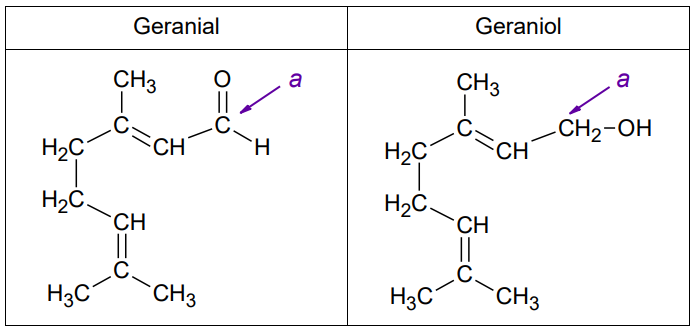
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
Uzupełnij tabelę. Wpisz formalny stopień utlenienia oraz typ hybrydyzacji (sp, sp2, sp3) orbitali walencyjnych atomu węgla oznaczonego literą a w cząsteczkach geranialu i geraniolu.
Ocena poprawności zdań dotyczących geraniolu i geranialu. Zadanie 27.2. Arkusz CKE chemia maj 2023 rozszerzony (1 punkt)
Poniżej przedstawiono wzory półstrukturalne (grupowe) dwóch związków zapachowych: geranialu oraz geraniolu.

Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
Oceń prawdziwość poniższych zdań. Zaznacz P, jeśli zdanie jest prawdziwe, albo F – jeśli jest fałszywe. 1. Geraniol jest produktem redukcji geranialu. 2. W cząsteczce geranialu liczba wiązań 𝜋 jest większa niż w cząsteczce geraniolu.
Obliczanie stężeniowej stałej równowagi syntezy fosgenu. Zadanie 28. Arkusz CKE chemia maj 2023 rozszerzony (2 punkty)
Fosgen to silnie trujący związek o wzorze COCl2. W reakcjach fosgenu z alkoholami otrzymuje się odpowiednie estry kwasu węglowego, a w procesach polikondensacji z udziałem fosgenu powstają poliwęglany – szeroko stosowane tworzywa zastępujące szkło. Substratami do otrzymywania fosgenu są tlenek węgla(II) i chlor. W mieszaninie tych gazów zachodzi – pod wpływem światła – odwracalna reakcja opisana równaniem:
CO (g) + Cl2 (g) ⇄ COCl2 (g)
Do reaktora o pojemności 4,0 dm3 wprowadzono gazowe substraty: 0,40 mol CO i 0,20 mol Cl2. Gdy w temperaturze 𝑇 ustaliła się równowaga, stwierdzono, że przereagowało 80% chloru.
Oblicz stężeniową stałą równowagi syntezy fosgenu w temperaturze 𝑻.
Zapis równania reakcji fosgenu z metanolem. Zadanie 29. Arkusz CKE chemia maj 2023 rozszerzony (1 punkt)
Fosgen to silnie trujący związek o wzorze COCl2. W reakcjach fosgenu z alkoholami otrzymuje się odpowiednie estry kwasu węglowego, a w procesach polikondensacji z udziałem fosgenu powstają poliwęglany – szeroko stosowane tworzywa zastępujące szkło. Substratami do otrzymywania fosgenu są tlenek węgla(II) i chlor. W mieszaninie tych gazów zachodzi – pod wpływem światła – odwracalna reakcja opisana równaniem:
CO (g) + Cl2 (g) ⇄ COCl2 (g)
Napisz równanie reakcji fosgenu z metanolem w stosunku molowym 1 : 2. Zastosuj wzory półstrukturalne (grupowe) związków organicznych.
Zapis równania reakcji otrzymywania poliwęglanu. Zadanie 30. Arkusz CKE chemia maj 2023 rozszerzony (1 punkt)
Fosgen to silnie trujący związek o wzorze COCl2. W reakcjach fosgenu z alkoholami otrzymuje się odpowiednie estry kwasu węglowego, a w procesach polikondensacji z udziałem fosgenu powstają poliwęglany – szeroko stosowane tworzywa zastępujące szkło. Substratami do otrzymywania fosgenu są tlenek węgla(II) i chlor. W mieszaninie tych gazów zachodzi – pod wpływem światła – odwracalna reakcja opisana równaniem:
CO (g) + Cl2 (g) ⇄ COCl2 (g)
Bisfenol A, którego wzór przedstawiono poniżej, stosuje się do otrzymywania poliwęglanu.
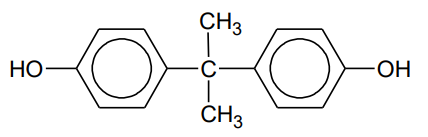
W tym celu bisfenol A poddaje się najpierw reakcji z wodorotlenkiem sodu, która przebiega tak samo jak reakcja tego wodorotlenku z fenolem, a następnie przeprowadza się polikondensację produktu tej reakcji z fosgenem.
Uzupełnij schemat tak, aby powstało równanie reakcji otrzymywania poliwęglanu z bisfenolanu sodu i fosgenu.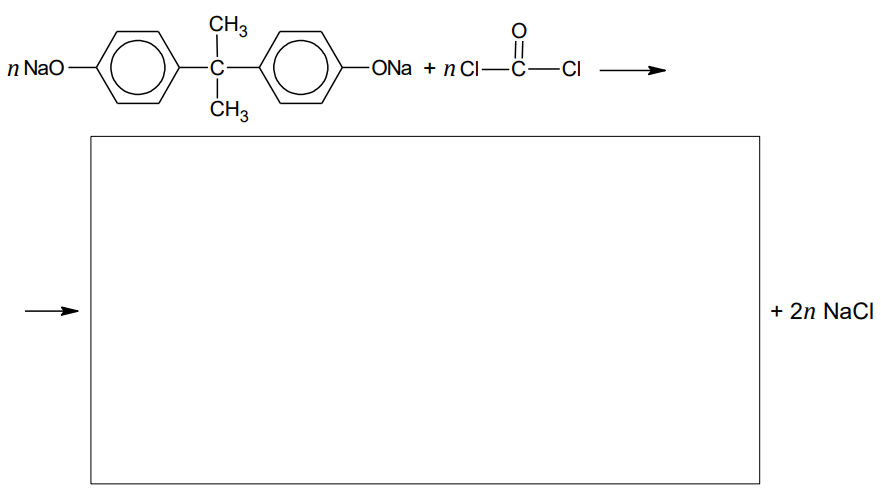
Zapis wzoru grupowego właściwej formy alaniny oraz wskazanie nazwy określonej wartości pH roztworu. Zadanie 31.1. Arkusz CKE chemia maj 2023 rozszerzony (1 punkt)
Do zakwaszonego roztworu alaniny dodawano kroplami wodny roztwór wodorotlenku sodu i mierzono pH mieszaniny reakcyjnej. Na poniższym wykresie zilustrowano zależność pH mieszaniny od objętości dodanego roztworu wodorotlenku sodu (w jednostkach umownych).
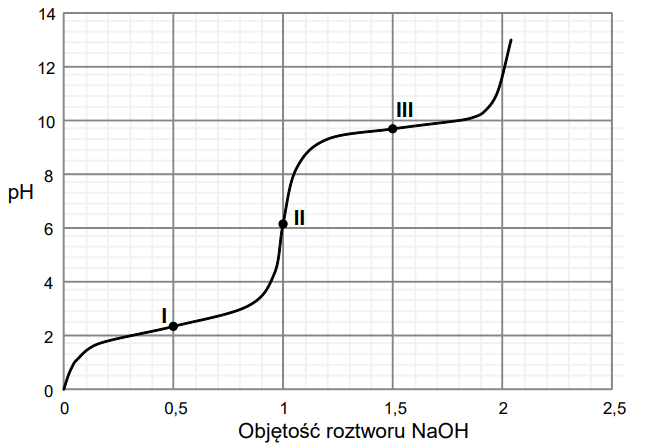
Aminokwasy w roztworach wodnych istnieją głównie w formie jonów. W roztworach o niskim pH cząsteczka aminokwasu jest protonowana. W pewnym zakresie pH dominującą formą jest jon obojnaczy. W roztworach o wysokim pH cząsteczka aminokwasu traci proton. W punkcie oznaczonym na wykresie numerem I alanina jest mieszaniną formy protonowanej i jonu obojnaczego w stosunku molowym 1 : 1, a w punkcie oznaczonym na wykresie numerem III ten aminokwas jest mieszaniną jonu obojnaczego i formy zdeprotonowanej w stosunku molowym 1 : 1.
Na podstawie: J. McMurry, Chemia organiczna, Warszawa 2005.
Napisz wzór półstrukturalny (grupowy) tej formy alaniny, która występuje przy wartości pH odpowiadającej punktowi II zaznaczonemu na wykresie. Podaj nazwę tej wartości pH. Wzór: Nazwa:
Wybór właściwych form alaniny występujących przy określonej wartości pH roztworu. Zadanie 31.2. Arkusz CKE chemia maj 2023 rozszerzony (1 punkt)
Do zakwaszonego roztworu alaniny dodawano kroplami wodny roztwór wodorotlenku sodu i mierzono pH mieszaniny reakcyjnej. Na poniższym wykresie zilustrowano zależność pH mieszaniny od objętości dodanego roztworu wodorotlenku sodu (w jednostkach umownych).

Aminokwasy w roztworach wodnych istnieją głównie w formie jonów. W roztworach o niskim pH cząsteczka aminokwasu jest protonowana. W pewnym zakresie pH dominującą formą jest jon obojnaczy. W roztworach o wysokim pH cząsteczka aminokwasu traci proton. W punkcie oznaczonym na wykresie numerem I alanina jest mieszaniną formy protonowanej i jonu obojnaczego w stosunku molowym 1 : 1, a w punkcie oznaczonym na wykresie numerem III ten aminokwas jest mieszaniną jonu obojnaczego i formy zdeprotonowanej w stosunku molowym 1 : 1.
Na podstawie: J. McMurry, Chemia organiczna, Warszawa 2005.
Spośród poniższych wzorów form alaniny wybierz i zaznacz wzory tych, które obecne są w roztworze o wartości pH odpowiadającej punktowi III, zaznaczonemu na wykresie.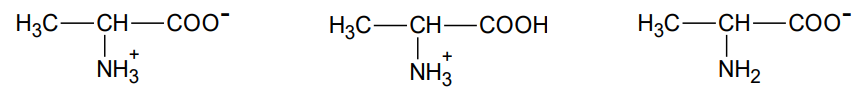
Sformułowanie wniosków dotyczących budowy i właściwości cząsteczek glukozy biorącej udział w próbie Trommera. Zadanie 32. Arkusz CKE chemia maj 2023 rozszerzony (2 punkty)
Przygotowano zalkalizowaną zawiesinę wodorotlenku miedzi(II). Wygląd zawartości probówki przedstawiono na zdjęciu:

Wykonano doświadczenie: do probówki zawierającej otrzymany odczynnik wprowadzono wodny roztwór glukozy i wymieszano zawartość naczynia (I etap). Następnie probówkę ogrzano (II etap).
Na poniższych zdjęciach przedstawiono wygląd zawartości probówki
po każdym z dwóch etapów doświadczenia.

Na podstawie wyniku I etapu doświadczenia sformułuj i napisz wniosek dotyczący budowy cząsteczki glukozy, a na podstawie wyniku II etapu doświadczenia – wniosek dotyczący właściwości tego monosacharydu. Wniosek dotyczący budowy cząsteczki glukozy: Wniosek dotyczący właściwości glukozy:
Ocena poprawności zdań dotyczących cząsteczek dwóch monosacharydów. Zadanie 33. Arkusz CKE chemia maj 2023 rozszerzony (1 punkt)
Poniżej przedstawiono wzory ilustrujące budowę pary monosacharydów.
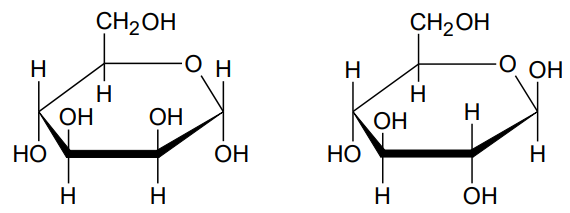
Oceń prawdziwość poniższych zdań. Zaznacz P, jeśli zdanie jest prawdziwe, albo F – jeśli jest fałszywe. 1. Oba monosacharydy należą do szeregu konfiguracyjnego D. 2. Oba monosacharydy należą do grupy ketoheksoz.
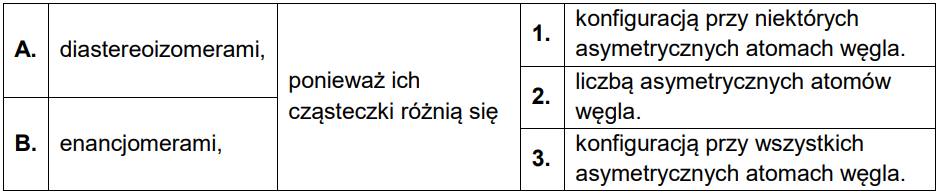
Wybór właściwych określeń dotyczących stereochemii cząsteczek monosacharydów. Zadanie 34. Arkusz CKE chemia maj 2023 rozszerzony (1 punkt)
Poniżej przedstawiono wzory ilustrujące budowę pary monosacharydów.

Dokończ zdanie. Wybierz i zaznacz odpowiedź A albo B oraz uzasadnienie 1., 2. albo 3. Przedstawione monosacharydy są względem siebie