Określanie symboli pierwiastków chemicznych. Zadanie 1.1. Arkusz CKE chemia maj 2023 rozszerzony (1 punkt)
O dwóch pierwiastkach umownie oznaczonych literami A i X wiadomo, że:
• należą do tego samego bloku konfiguracyjnego
• liczba masowa jednego z izotopów pierwiastka A jest dwa razy większa od jego liczby atomowej i jest równa liczbie atomowej niklu
• suma elektronów, neutronów i protonów w atomie jednego z izotopów pierwiastka X jest równa 114, a liczba nukleonów jest równa 79.
Uzupełnij tabelę. Wpisz symbol pierwiastka A i symbol pierwiastka X oraz symbol bloku konfiguracyjnego, do którego należą te pierwiastki.
Graficzny zapis walencyjnej konfiguracji elektronowej atomu pierwiastka w stanie podstawowym. Zadanie 1.2. Arkusz CKE chemia maj 2023 rozszerzony (1 punkt)
O dwóch pierwiastkach umownie oznaczonych literami A i X wiadomo, że:
• należą do tego samego bloku konfiguracyjnego
• liczba masowa jednego z izotopów pierwiastka A jest dwa razy większa od jego liczby atomowej i jest równa liczbie atomowej niklu
• suma elektronów, neutronów i protonów w atomie jednego z izotopów pierwiastka X jest równa 114, a liczba nukleonów jest równa 79.
Napisz fragment konfiguracji elektronowej atomu A (w stanie podstawowym) opisujący rozmieszczenie elektronów walencyjnych na podpowłokach. Zastosuj graficzny zapis konfiguracji elektronowej. W tym zapisie uwzględnij numer powłoki i symbole podpowłok.
Przypisywanie liczb kwantowych niesparowanemu elektronowi. Zadanie 1.3. Arkusz CKE chemia maj 2023 rozszerzony (1 punkt)
O dwóch pierwiastkach umownie oznaczonych literami A i X wiadomo, że:
• należą do tego samego bloku konfiguracyjnego
• liczba masowa jednego z izotopów pierwiastka A jest dwa razy większa od jego liczby atomowej i jest równa liczbie atomowej niklu
• suma elektronów, neutronów i protonów w atomie jednego z izotopów pierwiastka X jest równa 114, a liczba nukleonów jest równa 79.
Wpisz do tabeli wartości liczb kwantowych opisujących stan energetyczny niesparowanego elektronu walencyjnego atomu X (w stanie podstawowym).
Zapis równania reakcji rozpadu promieniotwórczego. Zadanie 2. Arkusz CKE chemia maj 2023 rozszerzony (1 punkt)
Aby otrzymać superciężkie jądra pierwiastków z końca 7. okresu, kaliforn 249Cf bombardowano jonami izotopu wapnia 48Ca. Podczas jednego z eksperymentów zarejestrowano przemianę:
![]()
Powstałe jądro X uległo rozpadowi, którego głównym produktem był liwermor 290Lv.
Napisz równanie reakcji rozpadu, której uległo jądro pierwiastka X. Uzupełnij wszystkie pola w poniższym schemacie.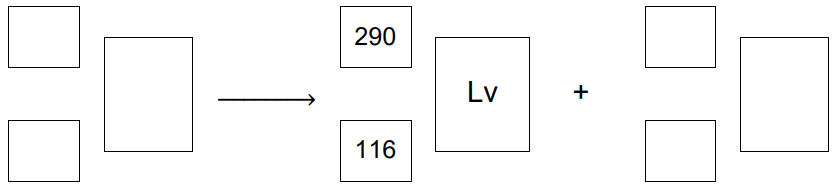
Ocena poprawności zdań dotyczących odmian alotropowych węgla. Zadanie 3. Arkusz CKE chemia maj 2023 rozszerzony (1 punkt)
Węgiel tworzy kilka odmian alotropowych, które różnią się strukturą krystaliczną. Są wśród nich diament, grafit i fulereny.
Oceń prawdziwość poniższych zdań. Zaznacz P, jeśli zdanie jest prawdziwe, albo F – jeśli jest fałszywe. 1. Odmienna budowa wewnętrzna diamentu, grafitu i fulerenów jest przyczyną różnic ich właściwości chemicznych, przy zachowaniu identycznych właściwości fizycznych. 2. W krysztale diamentu każdy z atomów węgla tworzy kowalencyjne wiązania 𝜎 z czterema otaczającymi go atomami.
Rysowanie wzoru elektronowego cząsteczki ditlenku triwęgla oraz wskazanie liczby wiązań sigma oraz atomów węgla o hybrydyzacji sp. Zadanie 4. Arkusz CKE chemia maj 2023 rozszerzony (2 punkty)
Ze względu na zdolność atomów węgla do łączenia się w łańcuchy ten pierwiastek tworzy z tlenem nie tylko związki takie jak CO i CO2, lecz także mniej typowe połączenia. Jednym z nich jest ditlenek triwęgla o wzorze sumarycznym C3O2. Cząsteczka tego związku ma budowę liniową, atomami wewnętrznymi są w niej atomy węgla, a skrajnymi – atomy tlenu. Ditlenek triwęgla reaguje zarówno z wodą, jak i z amoniakiem. W każdej z tych reakcji powstaje jeden produkt. W reakcji z wodą tworzy się kwas dikarboksylowy, a w reakcji z amoniakiem – diamid tego kwasu.
Na podstawie: J.E. House, Inorganic Chemistry, Elsevier, 2008.
Narysuj wzór elektronowy cząsteczki C3O2 (zaznacz kreskami wiązania chemiczne i wolne pary elektronowe). Uzupełnij poniższe zdania. Wybierz i zaznacz jedną odpowiedź spośród podanych w każdym nawiasie. Wzór elektronowy: Aby wyjaśnić budowę cząsteczki C3O2, hybrydyzację typu sp przypisuje się orbitalom walencyjnym (trzech atomów / dwóch atomów / jednego atomu) węgla. Liczba wiązań sigma w cząsteczce C3O2 wynosi (2 / 4 / 6 / 8).
Rysowanie wzorów grupowych kwasu karboksylowego oraz amidu powstałych z ditlenku triwęgla. Zadanie 5. Arkusz CKE chemia maj 2023 rozszerzony (2 punkty)
Ze względu na zdolność atomów węgla do łączenia się w łańcuchy ten pierwiastek tworzy z tlenem nie tylko związki takie jak CO i CO2, lecz także mniej typowe połączenia. Jednym z nich jest ditlenek triwęgla o wzorze sumarycznym C3O2. Cząsteczka tego związku ma budowę liniową, atomami wewnętrznymi są w niej atomy węgla, a skrajnymi – atomy tlenu. Ditlenek triwęgla reaguje zarówno z wodą, jak i z amoniakiem. W każdej z tych reakcji powstaje jeden produkt. W reakcji z wodą tworzy się kwas dikarboksylowy, a w reakcji z amoniakiem – diamid tego kwasu.
Na podstawie: J.E. House, Inorganic Chemistry, Elsevier, 2008.
Narysuj wzory półstrukturalne (grupowe) produktów opisanych reakcji ditlenku triwęgla z wodą i amoniakiem. 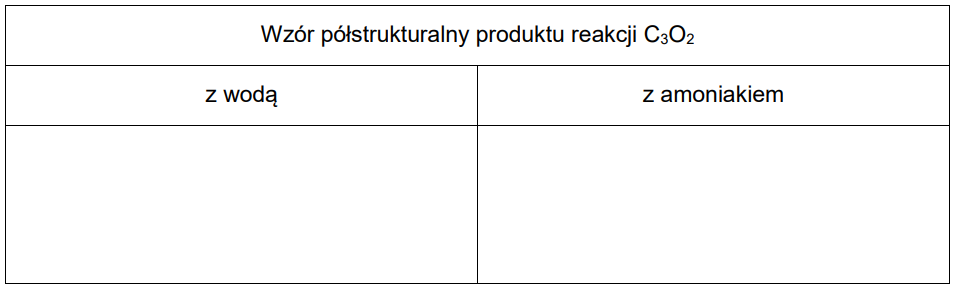
Obliczanie szybkości reakcji w momencie przereagowania 50% ilości jednego z substratów. Zadanie 6. Arkusz CKE chemia maj 2023 rozszerzony (2 punkty)
Pewna reakcja chemiczna:
2A (g) + B (g) ⇄ 2C (g)
przebiega w temperaturze 298 K według równania kinetycznego: 𝑣 = 𝑘 ∙ cA2 ∙ cB . Stała szybkości 𝑘 opisanej przemiany w temperaturze 298 K jest równa 6,7 ∙ 103 dm6 ∙ mol–2 ∙ s–1 . Początkowe stężenie substancji A wynosiło 4 mol ∙ dm−3 , a początkowe stężenie substancji B było równe 3 mol ∙ dm−3.
Oblicz szybkość opisanej reakcji w momencie, w którym przereagowało 𝟓𝟎 % początkowej ilości substancji B.
Wybór mocniejszego kwasu z uzasadnieniem wyboru. Zadanie 7. Arkusz CKE chemia maj 2023 rozszerzony (1 punkt)
W wodnych roztworach słabych kwasów jednoprotonowych zachodzi dysocjacja. Dla danej wartości stężenia molowego roztworu i w danej temperaturze ustala się stan równowagi między cząsteczkami i jonami obecnymi w roztworze. Na poniższym wykresie przedstawiono zależność stopnia dysocjacji (a) dwóch kwasów jednoprotonowych HX i HQ od stężenia molowego roztworu w temperaturze 20 °C.
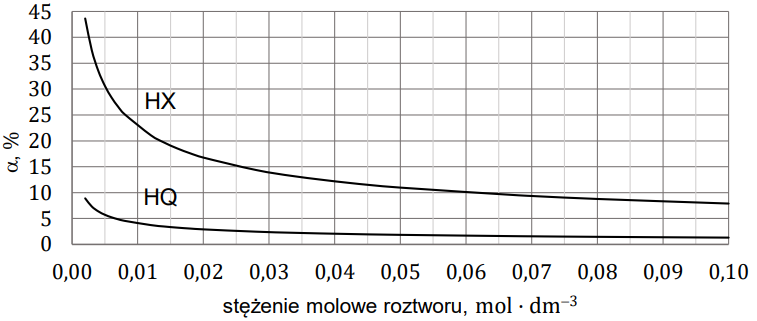
Wartości stopnia dysocjacji kwasu HX dla wybranych stężeń molowych (𝑐0) zebrano w tabeli (𝑡 = 20 °C).
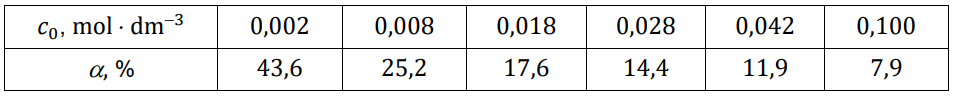
Rozstrzygnij, na podstawie analizy danych zamieszczonych na wykresie, który kwas (HX czy HQ) jest mocniejszy. Zaznacz jego wzór. Odpowiedź uzasadnij. HX HQ Uzasadnienie:
Zadanie problemowe. Uzupełnienie tabeli, rysowanie wykresu oraz obliczanie stężenia molowego drobin. Zadanie 8. Arkusz CKE chemia maj 2023 rozszerzony (4 punkty)
W wodnych roztworach słabych kwasów jednoprotonowych zachodzi dysocjacja. Dla danej wartości stężenia molowego roztworu i w danej temperaturze ustala się stan równowagi między cząsteczkami i jonami obecnymi w roztworze. Na poniższym wykresie przedstawiono zależność stopnia dysocjacji (a) dwóch kwasów jednoprotonowych HX i HQ od stężenia molowego roztworu w temperaturze 20 °C.

Wartości stopnia dysocjacji kwasu HX dla wybranych stężeń molowych (𝑐0) zebrano w tabeli (𝑡 = 20 °C).

W poniższej tabeli umieszczono wartości pH czterech roztworów kwasu HX o wybranych stężeniach molowych, a na wykresie przedstawiono logarytmiczną zależność pH roztworu tego kwasu od jego stężenia molowego w zakresie stężeń od 0,002 mol × dm−3 do 0,028 mol × dm−3 (𝑡 = 20 °C).
Uzupełnij tabelę brakującymi wartościami pH (z dokładnością do jednego miejsca po przecinku) oraz dokończ wykres zależności pH roztworu kwasu HX od jego stężenia molowego. Następnie oblicz stężenie molowe jonów X− i stężenie molowe niezdysocjowanych cząsteczek HX w roztworze o pH = 𝟐,𝟐. Odczyt z wykresu wykonaj z dokładnością do 𝟎, 𝟎𝟎𝟐 𝐦𝐨𝐥 · 𝐝𝐦−𝟑 , a wartości stężenia molowego jonów X− i cząsteczek HX podaj z dokładnością do 𝟎, 𝟎𝟎𝟏 𝐦𝐨𝐥 · 𝐝𝐦−𝟑. W roztworze o pH = 2,2 stężenie molowe jonów X– jest równe , a stężenie molowe niezdysocjowanych cząsteczek kwasu HX jest równe . Rozwiązanie tego zadania dostępne jest nieodpłatnie pod poniższym linkiem: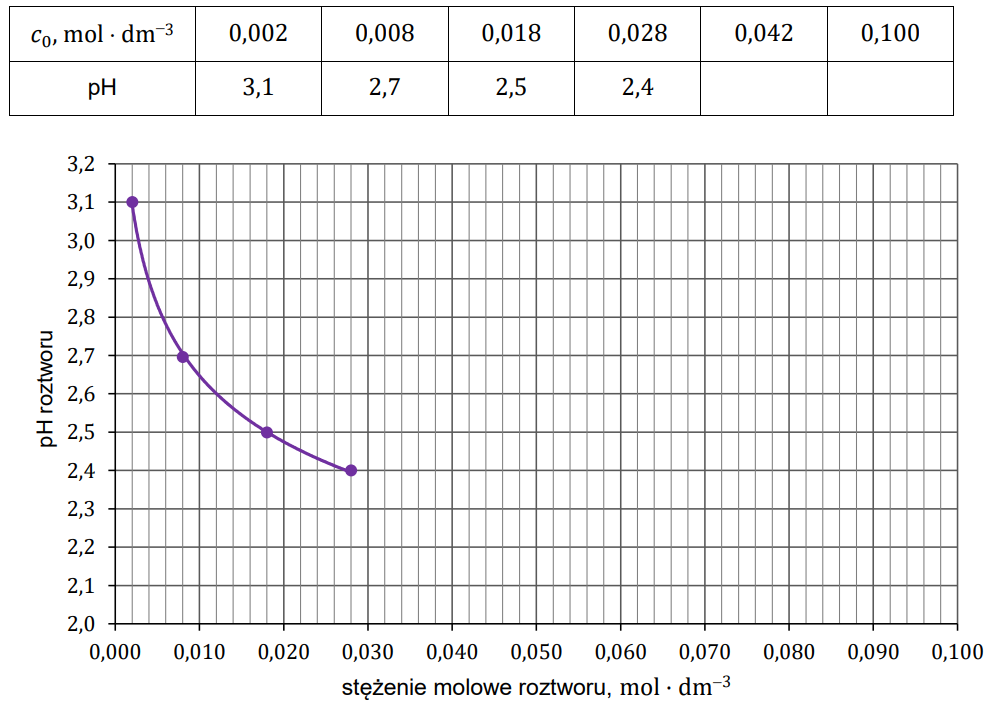
Zapis równania procesu zgodnie z teorią Brønsteda i wskazaniem sprzężonych par kwasów oraz zasad. Zadanie 9.1. Arkusz CKE chemia maj 2023 rozszerzony (1 punkt)
Przeprowadzono doświadczenie, w którym do dwóch probówek z wodnym roztworem Na2SO3 dodano:
– do probówki 1. – kilka kropel roztworu fenoloftaleiny
– do probówki 2. – nadmiar stężonego HCl (aq).
Wygląd zawartości probówki 1. po dodaniu do niej roztworu fenoloftaleiny pokazano na zdjęciu.

Wpisz do schematu wzory odpowiednich drobin tak, aby powstało równanie procesu decydującego o odczynie roztworu w probówce 1. Zastosuj definicję kwasu i zasady Brønsteda.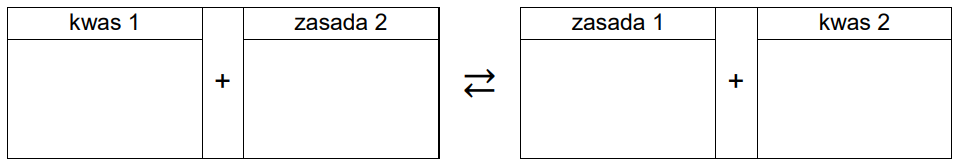
Zapis obserwacji oraz równania reakcji chemicznej w formie jonowej skróconej. Zadanie 9.2. Arkusz CKE chemia maj 2023 rozszerzony (1 punkt)
Przeprowadzono doświadczenie, w którym do dwóch probówek z wodnym roztworem Na2SO3 dodano:
– do probówki 1. – kilka kropel roztworu fenoloftaleiny
– do probówki 2. – nadmiar stężonego HCl (aq).
Napisz, co zaobserwowano podczas doświadczenia w probówce 2. po dodaniu odczynnika. Napisz w formie jonowej skróconej równanie reakcji, która była przyczyną zaobserwowanych zmian. Obserwacje: Równanie reakcji:
Rozstrzygnięcie czy miareczkowany kwas jest mocny czy słaby z dwoma uzasadnieniami. Zadanie 10. Arkusz CKE chemia maj 2023 rozszerzony (2 punkty)
Badano reakcje mocnego kwasu HA i słabego kwasu HX z mocną zasadą. W tym celu wykonano miareczkowanie wodnych roztworów tych kwasów za pomocą wodnego roztworu wodorotlenku potasu – zgodnie z poniższym opisem. Umieszczono w zlewce 20,0 cm3 roztworu wybranego kwasu o stężeniu 0,10 mol ∙ dm−3 i zmierzono pH tego roztworu. Następnie do zlewki z roztworem kwasu dodawano porcjami wodny roztwór KOH o stężeniu 0,10 mol ∙ dm−3 . Po dodaniu każdej porcji roztworu wodorotlenku mierzono pH mieszaniny reakcyjnej. Punkt równoważnikowy (PR) został osiągnięty po dodaniu takiej objętości roztworu KOH, w jakiej liczba moli zasady jest równa liczbie moli kwasu. Uzyskane wyniki przedstawiono w formie wykresu zależności mierzonego pH od objętości roztworu KOH – naniesione punkty połączono, w wyniku czego otrzymano krzywą miareczkowania. Poniżej przedstawiono krzywą miareczkowania wodnego roztworu jednego z tych kwasów (HA albo HX) wodnym roztworem wodorotlenku potasu.
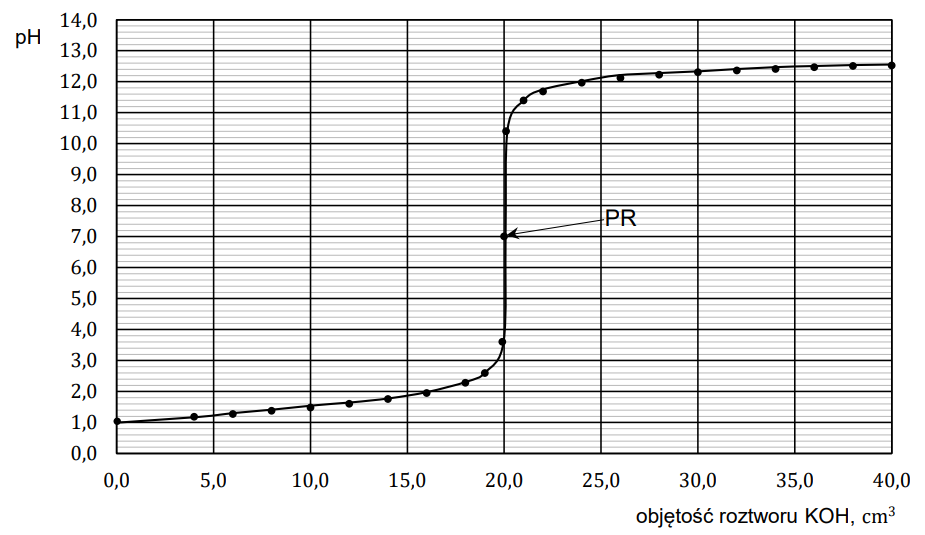
Rozstrzygnij, czy przedstawiony wykres ilustruje wyniki miareczkowania wodnego roztworu słabego kwasu HX wodnym roztworem KOH w opisanym doświadczeniu. Odpowiedź uzasadnij – przytocz dwa różne argumenty. Uzasadnienie: 1. 2.
Zapis w formie jonowej skróconej równania reakcji strącania chlorku ołowiu(II). Zadanie 11.1. Arkusz CKE chemia maj 2023 rozszerzony (1 punkt)
Chlorek ołowiu(II) i jodek ołowiu(II) są solami trudno rozpuszczalnymi w wodzie, ale wartości ich iloczynu rozpuszczalności znacznie się różnią. Na zdjęciach przedstawiono świeżo wytrącone osady: chlorku ołowiu(II) w probówce 1. i jodku ołowiu(II) w probówce 2.

Aby doświadczalnie potwierdzić, że obie sole są trudno rozpuszczalne w wodzie oraz że rozpuszczalność jodku ołowiu(II) jest znacznie mniejsza niż rozpuszczalność chlorku ołowiu(II), przygotowano zestaw laboratoryjny składający się:
− z probówki, w której umieszczono 2 cm3 wodnego roztworu azotanu(V) ołowiu(II) o stężeniu 0,1 mol ∙ dm−3
− ze zlewki z wodnym roztworem chlorku potasu o stężeniu 0,1 mol ∙ dm−3
− ze zlewki z wodnym roztworem jodku potasu o stężeniu 0,1 mol ∙ dm−3
− z wielomiarowych pipet.
Napisz w formie jonowej skróconej równanie reakcji strącania chlorku ołowiu(II).
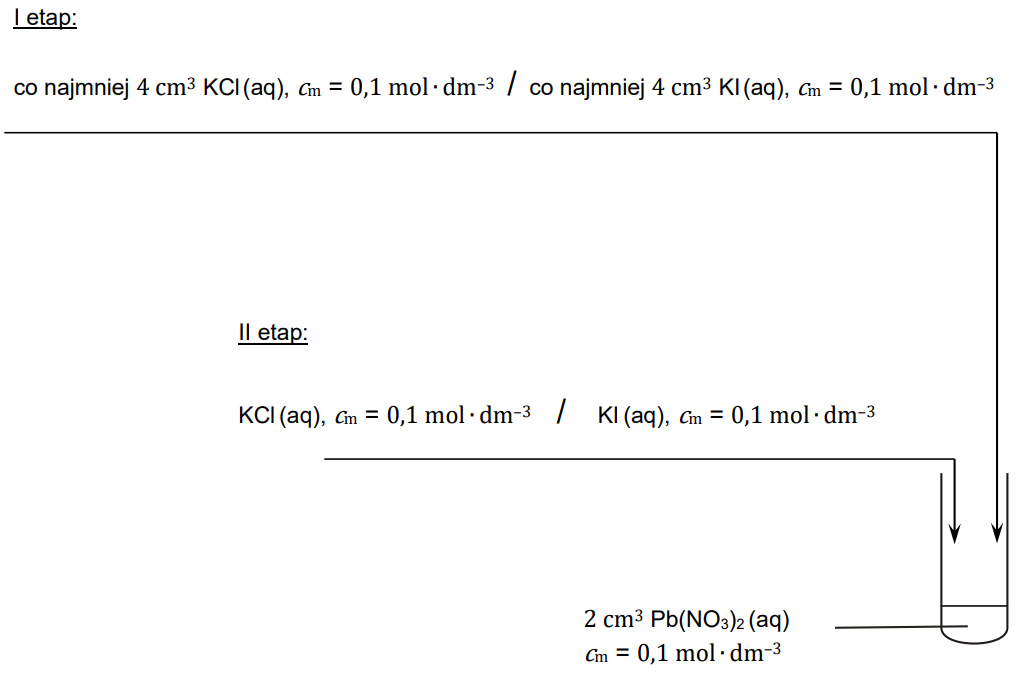
Wybór właściwych odczynników oraz zapis zmian w dwóch etapach doświadczenia. Zadanie 11.2. Arkusz CKE chemia maj 2023 rozszerzony (2 punkty)
Chlorek ołowiu(II) i jodek ołowiu(II) są solami trudno rozpuszczalnymi w wodzie, ale wartości ich iloczynu rozpuszczalności znacznie się różnią. Na zdjęciach przedstawiono świeżo wytrącone osady: chlorku ołowiu(II) w probówce 1. i jodku ołowiu(II) w probówce 2.

Aby doświadczalnie potwierdzić, że obie sole są trudno rozpuszczalne w wodzie oraz że rozpuszczalność jodku ołowiu(II) jest znacznie mniejsza niż rozpuszczalność chlorku ołowiu(II), przygotowano zestaw laboratoryjny składający się:
− z probówki, w której umieszczono 2 cm3 wodnego roztworu azotanu(V) ołowiu(II) o stężeniu 0,1 mol ∙ dm−3
− ze zlewki z wodnym roztworem chlorku potasu o stężeniu 0,1 mol ∙ dm−3
− ze zlewki z wodnym roztworem jodku potasu o stężeniu 0,1 mol ∙ dm−3
− z wielomiarowych pipet.
Wybierz i zaznacz na poniższym schemacie doświadczenia roztwór, który należy dodać do wodnego roztworu azotanu(V) ołowiu(II): Obserwowane zmiany: I etap: II etap:
• jako pierwszy – w I etapie doświadczenia
• jako drugi – w II etapie doświadczenia,
aby w obu etapach nastąpiły wyraźne zmiany wyglądu zawartości probówki. Opisz zmiany, jakie można zaobserwować podczas I etapu doświadczenia, a następnie – podczas II etapu doświadczenia.