Wybór wskaźnika użytego podczas miareczkowania roztworu kwasu octowego roztworem zasady sodowej. Zadanie 11. Arkusz CKE chemia maj 2018 rozszerzony (1 punkt)
Do wodnego roztworu kwasu etanowego (octowego) o określonej objętości, ale o nieznanym stężeniu, dodawano kroplami wodny roztwór wodorotlenku sodu o znanym stężeniu i za pomocą pehametru mierzono pH mieszaniny reakcyjnej. W ten sposób przeprowadzono tzw. miareczkowanie pehametryczne, które jest jedną z metod analizy ilościowej. W czasie doświadczenia zachodziła reakcja opisana równaniem:
CH3COOH + NaOH → CH3COONa + H2O
Zestaw użyty w tym doświadczeniu przedstawiono na poniższym schemacie, a otrzymane wyniki miareczkowania umieszczono na wykresie.
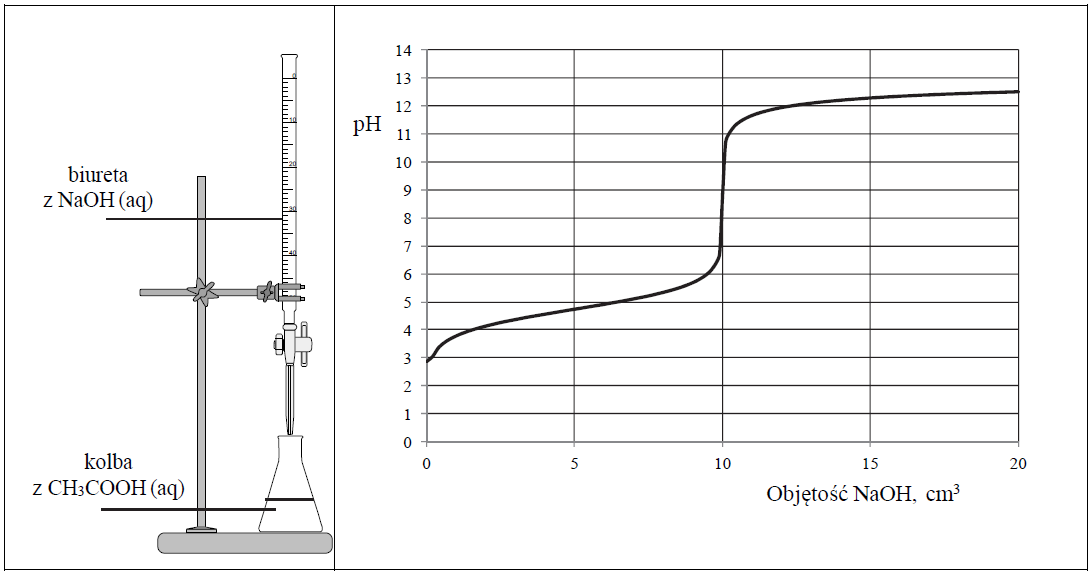
Po dodaniu takiej objętości roztworu wodorotlenku sodu, w jakiej znajdowała się liczba moli NaOH równa liczbie moli CH3COOH w roztworze wziętym do analizy, w układzie został osiągnięty punkt równoważnikowy. Ustalono, że w opisanym doświadczeniu pH w punkcie równoważnikowym było równe 9.
Podczas miareczkowania kwas–zasada zamiast pehametru można stosować wskaźniki pH. Muszą one być tak dobrane, aby zakres zmiany barwy wskaźnika przypadał w pobliżu punktu równoważnikowego miareczkowania.
Właściwości wybranych wskaźników oznaczonych numerami I, II, III i IV przedstawiono w poniższej tabeli.
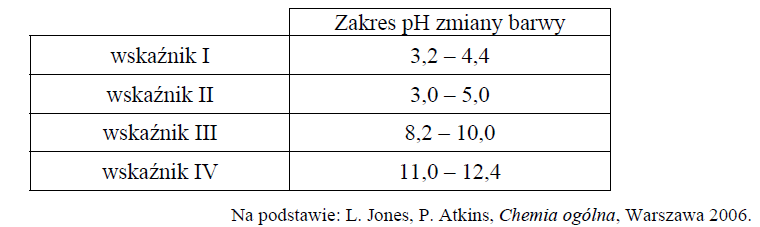
Spośród wskaźników podanych w tabeli i oznaczonych numerami I, II, III i IV wybierz i podaj numer tego wskaźnika, który powinien zostać użyty podczas opisanego miareczkowania roztworu kwasu etanowego.
Określenie odczynu roztworu w punkcie równoważnikowym miareczkowania. Zadanie 12. Arkusz CKE chemia maj 2018 rozszerzony (1 punkt)
Do wodnego roztworu kwasu etanowego (octowego) o określonej objętości, ale o nieznanym stężeniu, dodawano kroplami wodny roztwór wodorotlenku sodu o znanym stężeniu i za pomocą pehametru mierzono pH mieszaniny reakcyjnej. W ten sposób przeprowadzono tzw. miareczkowanie pehametryczne, które jest jedną z metod analizy ilościowej. W czasie doświadczenia zachodziła reakcja opisana równaniem:
CH3COOH + NaOH → CH3COONa + H2O
Zestaw użyty w tym doświadczeniu przedstawiono na poniższym schemacie, a otrzymane wyniki miareczkowania umieszczono na wykresie.

Po dodaniu takiej objętości roztworu wodorotlenku sodu, w jakiej znajdowała się liczba moli NaOH równa liczbie moli CH3COOH w roztworze wziętym do analizy, w układzie został osiągnięty punkt równoważnikowy. Ustalono, że w opisanym doświadczeniu pH w punkcie równoważnikowym było równe 9.
Uzupełnij poniższe zdanie – wybierz i podkreśl jedno określenie spośród podanych w nawiasie. Odpowiedź uzasadnij, odwołując się do procesu zachodzącego w roztworze. W opisanym doświadczeniu odczyn roztworu w punkcie równoważnikowym jest (kwasowy / obojętny / zasadowy). Uzasadnienie:
Wskazanie wzoru jonu, którego stężenie jest największe po zakończeniu miareczkowania. Zadanie 13. Arkusz CKE chemia maj 2018 rozszerzony (1 punkt)
Do wodnego roztworu kwasu etanowego (octowego) o określonej objętości, ale o nieznanym stężeniu, dodawano kroplami wodny roztwór wodorotlenku sodu o znanym stężeniu i za pomocą pehametru mierzono pH mieszaniny reakcyjnej. W ten sposób przeprowadzono tzw. miareczkowanie pehametryczne, które jest jedną z metod analizy ilościowej. W czasie doświadczenia zachodziła reakcja opisana równaniem:
CH3COOH + NaOH → CH3COONa + H2O
Zestaw użyty w tym doświadczeniu przedstawiono na poniższym schemacie, a otrzymane wyniki miareczkowania umieszczono na wykresie.

Po dodaniu takiej objętości roztworu wodorotlenku sodu, w jakiej znajdowała się liczba moli NaOH równa liczbie moli CH3COOH w roztworze wziętym do analizy, w układzie został osiągnięty punkt równoważnikowy. Ustalono, że w opisanym doświadczeniu pH w punkcie równoważnikowym było równe 9.
Podaj wzór jonu, którego stężenie jest największe w roztworze otrzymanym po dodaniu 18 cm3 wodnego roztworu wodorotlenku sodu do analizowanego roztworu kwasu etanowego.
Obliczanie wartości stałej równowagi reakcji chemicznej. Zadanie 14. Arkusz CKE chemia maj 2018 rozszerzony (2 punkty)
Dwa gazy A i B zmieszane w stosunku molowym nA : nB = 1 : 4 zajmują w warunkach normalnych objętość 1 dm3. Tę mieszaninę umieszczono w reaktorze o stałej pojemności 1 dm3 i w temperaturze T zainicjowano reakcję. W tej temperaturze ustalił się stan równowagi opisany równaniem:
A (g) + 2B (g) ⇄ 2C (g) ΔH < 0
W stanie równowagi stężenie substancji C było równe 0,004 mol · dm–3.
Oblicz stężeniową stałą równowagi (Kc) opisanej reakcji w temperaturze T.
Ocena poprawności zdań dotyczących reakcji równowagowej. Zadanie 15. Arkusz CKE chemia maj 2018 rozszerzony (1 punkt)
Dwa gazy A i B zmieszane w stosunku molowym nA : nB = 1 : 4 zajmują w warunkach normalnych objętość 1 dm3. Tę mieszaninę umieszczono w reaktorze o stałej pojemności 1 dm3 i w temperaturze T zainicjowano reakcję. W tej temperaturze ustalił się stan równowagi opisany równaniem:
A (g) + 2B (g) ⇄ 2C (g) ΔH < 0
W stanie równowagi stężenie substancji C było równe 0,004 mol · dm–3.
Oceń, czy poniższe informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa. 1. W stałej temperaturze T ciśnienie w reaktorze w stanie równowagi było niższe niż w chwili początkowej. 2. W warunkach izotermicznych (T = const) wzrost ciśnienia wywołany sprężeniem mieszaniny gazów w stanie równowagi poskutkuje spadkiem wydajności otrzymywania substancji C. 3. W warunkach izobarycznych (p = const) wzrost temperatury mieszaniny gazów w stanie równowagi poskutkuje spadkiem wydajności otrzymywania substancji C.
Zapis równań reakcji z użyciem buforu fosforanowego w środowisku kwasowym i zasadowym. Zadanie 17. Arkusz CKE chemia maj 2018 rozszerzony (1 punkt)
Wartości pH wody oraz wodnych roztworów kwasów i wodorotlenków mogą ulegać znacznym zmianom podczas dodawania do nich mocnych kwasów lub zasad. Istnieją jednak roztwory, których pH zmienia się nieznacznie po dodaniu mocnego kwasu lub zasady na skutek reakcji składników roztworu z jonami wodorowymi lub jonami wodorotlenkowymi. Nazywamy je buforami pH. Buforowe właściwości mają roztwory zawierające sprzężoną parę kwas–zasada Brønsteda w podobnych stężeniach, np.: słaby kwas i jego sól z mocną zasadą, słabą zasadę i jej sól z mocnym kwasem, słaby kwas wieloprotonowy i jego wodorosól lub mieszaninę wodorosoli.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2004.
Jednym z buforów odpowiedzialnych za utrzymanie równowagi kwasowo-zasadowej krwi jest bufor fosforanowy, który można otrzymać przez rozpuszczenie dwóch wodorosoli kwasu ortofosforowego(V) w wodzie.
Napisz w formie jonowej skróconej dwa równania reakcji ilustrujące działanie opisanego buforu fosforanowego. Przyjmij, że substraty reagują w stosunku molowym 1 : 1.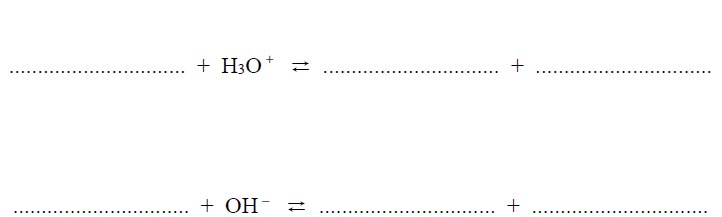
Uszeregowanie metali według według malejącej aktywności chemicznej. Zadanie 18.1. Arkusz CKE chemia maj 2018 rozszerzony (1 punkt)
Przeprowadzono doświadczenie, którego celem było porównanie aktywności chemicznej czterech metali: talu (Tl), technetu (Tc), hafnu (Hf) i molibdenu (Mo). Stwierdzono, że z udziałem wymienionych metali i ich jonów samorzutnie zachodzą reakcje, których przebieg ilustrują poniższe równania w formie jonowej skróconej:
I 3Hf + 4Mo3+ → 3Hf4+ + 4Mo
II 3Tl +Mo3+ → 3Tl+ +Mo
III Hf + Tc4+ → Hf4+ + Tc
IV Hf + 4Tl+ → Hf4+ + 4Tl
V 4Mo + 3Tc4+ → 4Mo3+ + 3Tc
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 1997.
Uszereguj wymienione metale według malejącej aktywności chemicznej – napisz ich symbole w odpowiedniej kolejności.
Wybór jonu stanowiącego najsilniejszy utleniacz i najsilniejszy reduktor. Zadanie 18.2. Arkusz CKE chemia maj 2018 rozszerzony (1 punkt)
Przeprowadzono doświadczenie, którego celem było porównanie aktywności chemicznej czterech metali: talu (Tl), technetu (Tc), hafnu (Hf) i molibdenu (Mo). Stwierdzono, że z udziałem wymienionych metali i ich jonów samorzutnie zachodzą reakcje, których przebieg ilustrują poniższe równania w formie jonowej skróconej:
I 3Hf + 4Mo3+ → 3Hf4+ + 4Mo
II 3Tl +Mo3+ → 3Tl+ +Mo
III Hf + Tc4+ → Hf4+ + Tc
IV Hf + 4Tl+ → Hf4+ + 4Tl
V 4Mo + 3Tc4+ → 4Mo3+ + 3Tc
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 1997.
Spośród kationów biorących udział w opisanych reakcjach wybierz jon, który jest najsilniejszym utleniaczem, i jon, który jest najsłabszym utleniaczem. Napisz wzory wybranych jonów. Najsilniejszy utleniacz: Najsłabszy utleniacz:
Obliczanie stężenia procentowego soli bezwodnej na podstawie rozpuszczalności jej hydratu. Zadanie 19. Arkusz CKE chemia maj 2018 rozszerzony (2 punkty)
W temperaturze 20 oC rozpuszczalność uwodnionego wodorosiarczanu(VI) sodu o wzorze NaHSO4 · H2O jest równa 67 gramów w 100 gramach wody.
Na podstawie: T. Mizerski, Tablice chemiczne, Warszawa 2004.
Oblicz, jaki procent masy roztworu nasyconego o temperaturze 20 oC stanowi masa soli bezwodnej NaHSO4.
Zapis równania reakcji otrzymywania wodorotlenku niklu(II). Zadanie 20. Arkusz CKE chemia maj 2018 rozszerzony (1 punkt)
Wodorotlenek niklu(II) strąca się jako zielonkawy osad z wodnego roztworu soli niklu(II) pod działaniem wodnego roztworu wodorotlenku sodu. Wodorotlenek niklu(II) nie rozpuszcza się w nadmiarze zasady, ale reaguje z kwasami. Pod wpływem utleniaczy ten wodorotlenek przechodzi w czarnobrunatny wodorotlenek niklu(III).
Na podstawie: J. Minczewski, Z. Marczenko, Chemia analityczna. Podstawy teoretyczne i analiza jakościowa, Warszawa 2001.
Do probówki z wodnym roztworem chlorku niklu(II) dodano nadmiar wodnego roztworu wodorotlenku sodu.
Napisz w formie jonowej skróconej równanie reakcji otrzymywania wodorotlenku niklu(II) w sposób opisany powyżej. Określ charakter chemiczny (kwasowy, zasadowy, obojętny, amfoteryczny) wodorotlenku niklu(II). Równanie reakcji: Charakter chemiczny wodorotlenku niklu(II):
Zapis równań połówkowych procesu utleniania oraz redukcji ze wskazaniem stosunku molowego utleniacza do reduktora. Zadanie 21. Arkusz CKE chemia maj 2018 rozszerzony (2 punkty)
Wodorotlenek niklu(II) strąca się jako zielonkawy osad z wodnego roztworu soli niklu(II) pod działaniem wodnego roztworu wodorotlenku sodu. Wodorotlenek niklu(II) nie rozpuszcza się w nadmiarze zasady, ale reaguje z kwasami. Pod wpływem utleniaczy ten wodorotlenek przechodzi w czarnobrunatny wodorotlenek niklu(III).
Na podstawie: J. Minczewski, Z. Marczenko, Chemia analityczna. Podstawy teoretyczne i analiza jakościowa, Warszawa 2001.
Utlenianie wodorotlenku niklu(II) do wodorotlenku niklu(III) za pomocą chloranu(I) sodu przebiega w środowisku wodnym zgodnie ze schematem:
![]()
Napisz w formie jonowej z uwzględnieniem liczby oddawanych lub pobieranych elektronów (zapis jonowo-elektronowy) równania procesów redukcji i utleniania zachodzących podczas opisanej reakcji. Określ stosunek molowy reduktora do utleniacza w tej reakcji. Równanie procesu redukcji: Równanie procesu utleniania: Stosunek molowy nreduktora : nutleniacza =
Opis zawartości naczynia po zakończeniu każdego etapu doświadczenia chemicznego. Zadanie 22. Arkusz CKE chemia maj 2018 rozszerzony (1 punkt)
Wodorotlenek niklu(II) strąca się jako zielonkawy osad z wodnego roztworu soli niklu(II) pod działaniem wodnego roztworu wodorotlenku sodu. Wodorotlenek niklu(II) nie rozpuszcza się w nadmiarze zasady, ale reaguje z kwasami. Pod wpływem utleniaczy ten wodorotlenek przechodzi w czarnobrunatny wodorotlenek niklu(III).
Na podstawie: J. Minczewski, Z. Marczenko, Chemia analityczna. Podstawy teoretyczne i analiza jakościowa, Warszawa 2001.
Do probówki zawierającej zielony roztwór chlorku niklu(II) dodano wodny roztwór wodorotlenku sodu, a następnie – bezbarwny wodny roztwór chloranu(I) sodu – zgodnie ze schematem:
![]()
Opisz wygląd zawartości probówki na początku doświadczenia oraz po reakcji I i po reakcji II. Uwzględnij rodzaj mieszaniny (roztwór, zawiesina) oraz jej barwę.
Określanie wzoru sumarycznego węglowodoru na podstawie danych ilościowych spalania składników mieszaniny. Zadanie 23. Arkusz CKE chemia maj 2018 rozszerzony (2 punkty)
Do całkowitego spalenia 2,80 dm3 (odmierzonych w warunkach normalnych) mieszaniny zawierającej 60% objętościowych pewnego gazowego alkanu i 40% objętościowych metanu potrzeba 13,16 dm3 tlenu w przeliczeniu na warunki normalne. Reakcje całkowitego spalania metanu oraz dowolnego alkanu przebiegają zgodnie z równaniami:
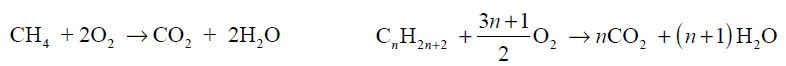
Wykonaj niezbędne obliczenia i podaj wzór sumaryczny alkanu stanowiącego 60% objętości opisanej mieszaniny.
Wybór poprawnych wyrazów dotyczących reakcji addycji przebiegającej według różnych mechanizmów. Zadanie 24. Arkusz CKE chemia maj 2018 rozszerzony (1 punkt)
Na przebieg reakcji propenu z bromowodorem ma wpływ obecność nadtlenków w mieszaninie reakcyjnej, co zilustrowano na poniższym schemacie.
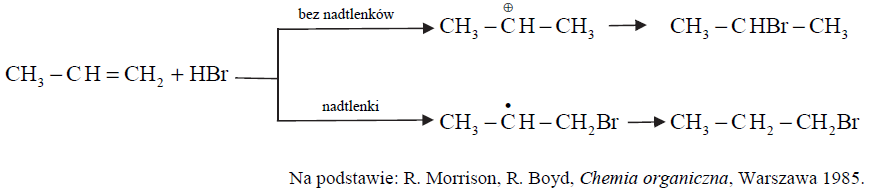
Uzupełnij poniższe zdania – wybierz i podkreśl jedno określenie spośród podanych w nawiasie. Gdy w środowisku reakcji nie ma nadtlenków, bromowodór przyłącza się do propenu (niezgodnie / zgodnie) z regułą Markownikowa. Ta addycja przebiega poprzez tworzenie drobin z ładunkiem dodatnim zlokalizowanym na atomie węgla. Jest to addycja (rodnikowa / nukleofilowa / elektrofilowa) do podwójnego wiązania węgiel – węgiel. Gdy w środowisku reakcji są obecne nadtlenki, addycja jest (niezgodna / zgodna) z regułą Markownikowa. W tej reakcji przejściowo tworzy się (karbokation pierwszorzędowy / karbokation drugorzędowy / rodnik pierwszorzędowy / rodnik drugorzędowy).