Zapis wzorów sumarycznych soli strąconych w postaci osadów. Zadanie 14.2. Arkusz CKE chemia maj 2015 rozszerzony (1 punkt)
W roztworze wodnym znajdują się kationy: Ba2+, Ag+ i Mg2+ oraz towarzyszące im aniony. Kationy te można wydzielić z roztworu za pomocą reakcji strąceniowych, stosując odpowiednie odczynniki w takiej kolejności, aby jeden odczynnik wytrącał z roztworu w postaci nierozpuszczalnej soli tylko jeden kation. Po przesączeniu osadu, używając innego odczynnika, można wytrącić z przesączu sól zawierającą kolejny kation.
Napisz wzory nierozpuszczalnych soli powstałych w każdym etapie doświadczenia.
Określanie odczynów roztworów wodnych z uzasadnieniem równaniami procesów chemicznych. Zadanie 15. Arkusz CKE chemia maj 2015 rozszerzony (2 punkty)
Wykonano doświadczenie zilustrowane na poniższym schemacie.

Określ odczyn roztworu powstałego w probówce I i odczyn roztworu powstałego w probówce II oraz napisz w formie jonowej skróconej równania reakcji zachodzących podczas tego doświadczenia.
Wskazanie funkcji jaką pełnią podane jony w teorii Brønsteda. Zadanie 16. Arkusz CKE chemia maj 2015 rozszerzony (1 punkt)
Wykonano doświadczenie zilustrowane na poniższym schemacie.

Określ, jaką funkcję (kwasu czy zasady) według teorii Brønsteda−Lowry’ego pełnią w reakcjach zachodzących podczas opisanego doświadczenia jony NH4+ i jony C17H35COO−. Jony NH4+ pełnią funkcję: Jony C17H35COO− pełnią funkcję:
Wybór właściwego wykresu ilustrującego profil energetyczny dwuetapowego procesu. Zadanie 17. Arkusz CKE chemia maj 2015 rozszerzony (1 punkt)
Pewien proces, w którym związek A zostaje przekształcony w związek B, przebiega w dwóch etapach.
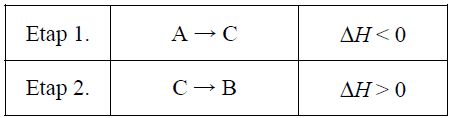
Przeanalizuj poniższe wykresy i ustal, który z nich odpowiada opisanej przemianie. Opisaną przemianę poprawnie zilustrowano na wykresie: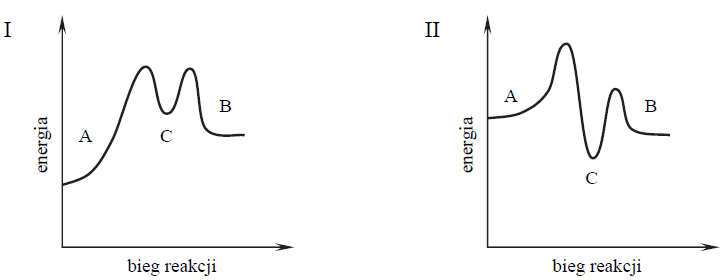
Obliczanie stężenia molowego nasyconego roztworu azotanu(V) potasu. Zadanie 18. Arkusz CKE chemia maj 2015 rozszerzony (2 punkty)
W temperaturze 20 °C rozpuszczalność azotanu(V) potasu jest równa 31,9 grama na 100 gramów wody.
Na podstawie: J. Sawicka i inni, Tablice chemiczne, Gdańsk 2004.
Oblicz stężenie molowe nasyconego wodnego roztworu azotanu(V) potasu w temperaturze 20 °C, jeżeli gęstość roztworu jest równa 1,16 g·cm−3.
Zaprojektowanie doświadczenia otrzymywania soli trzema wskazanymi metodami. Zadanie 19.1. Arkusz CKE chemia maj 2015 rozszerzony (1 punkt)
Sole można otrzymać między innymi w reakcjach:
1. tlenków metali z kwasami
2. metali z kwasami
3. wodorotlenków z kwasami.
Zaprojektuj doświadczenie, które pozwoli otrzymać rozpuszczalne w wodzie sole metodą 1. (probówka I), metodą 2. (probówka II) i metodą 3. (probówka III). Na schemacie doświadczenia wpisz wzory użytych odczynników wybranych spośród: Ag (s) HCl (aq) Al (s) CaO (s) H2SO4 (rozc) Cu(OH)2 (s)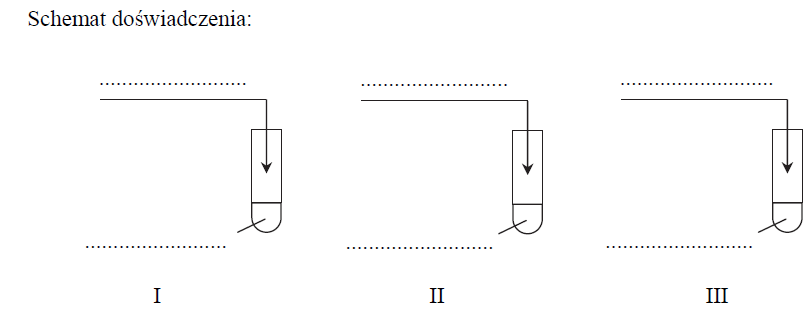
Zapis w formie jonowej skróconej równania przebiegającej reakcji chemicznej. Zadanie 19.2. Arkusz CKE chemia maj 2015 rozszerzony (1 punkt)
Sole można otrzymać między innymi w reakcjach:
1. tlenków metali z kwasami
2. metali z kwasami
3. wodorotlenków z kwasami.
Zaprojektowano doświadczenie, które pozwoli otrzymać rozpuszczalną w wodzie sól metodą 3. (probówka III). Użyto odczynniki wybrane spośród:
Ag (s) HCl (aq) Al (s) CaO (s) H2SO4 (rozc) Cu(OH)2 (s)
Napisz w formie jonowej skróconej równanie reakcji przebiegającej w probówce III.
Opis zmian obserwowanych w trakcie doświadczenia na podstawie obliczeń chemicznych. Zadanie 20. Arkusz CKE chemia maj 2015 rozszerzony (3 punkty)
Do 200 gramów wodnego roztworu chlorku glinu o stężeniu 15% (w procentach masowych) dodawano porcjami wodny roztwór wodorotlenku sodu zawierający 32 gramy NaOH, który całkowicie przereagował. Przebieg doświadczenia zilustrowano na poniższym schemacie.
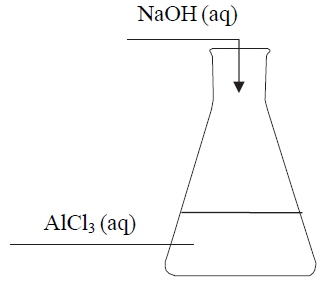
Wykonaj obliczenia i na podstawie uzyskanego wyniku opisz wszystkie zmiany możliwe do zaobserwowania podczas przebiegu tego doświadczenia. Obserwacje:
Zapis równań reakcji chemicznych przebiegających podczas dodawania roztworu NaOH do roztworu chlorku glinu. Zadanie 21. Arkusz CKE chemia maj 2015 rozszerzony (2 punkty)
Do 200 gramów wodnego roztworu chlorku glinu o stężeniu 15% (w procentach masowych) dodawano porcjami wodny roztwór wodorotlenku sodu zawierający 32 gramy NaOH, który całkowicie przereagował. Przebieg doświadczenia zilustrowano na poniższym schemacie.

Zapisz, w formie jonowej skróconej, równania wszystkich reakcji zachodzących podczas tego doświadczenia, jeżeli produktem jednej z nich jest jon kompleksowy, w którym glin ma liczbę koordynacyjną równą 4. Równania reakcji zapisz w kolejności, w jakiej zachodzą poszczególne procesy.
Obliczanie masy wodorotlenku glinu pozostałego w kolbie po zakończeniu doświadczenia. Zadanie 22. Arkusz CKE chemia maj 2015 rozszerzony (2 punkty)
Do 200 gramów wodnego roztworu chlorku glinu o stężeniu 15% (w procentach masowych) dodawano porcjami wodny roztwór wodorotlenku sodu zawierający 32 gramy NaOH, który całkowicie przereagował. Przebieg doświadczenia zilustrowano na poniższym schemacie.

Oblicz, ile gramów wodorotlenku glinu znajdowało się w kolbie po zakończeniu doświadczenia.
Zapis równań połówkowych procesów utleniania oraz redukcji w reakcji kwasu octowego z zakwaszonym roztworem manganianu(VII) potasu. Zadanie 23.1. Arkusz CKE chemia maj 2015 rozszerzony (2 punkty)
Manganian(VII) potasu reaguje z kwasem szczawiowym (kwasem etanodiowym HOOC–COOH) w środowisku kwasowym według następującego schematu:
MnO4– + (COOH)2 + H+ → Mn2+ + CO2 + H2O
Napisz w formie jonowej, z uwzględnieniem liczby oddawanych lub pobieranych elektronów (zapis jonowo-elektronowy), równania procesów redukcji i utleniania zachodzących podczas tej przemiany. Równanie procesu redukcji: Równanie procesu utleniania:
Uzupełnienie schematu reakcji utleniania kwasu szczawiowego zakwaszonym roztworem manganianu(VII) potasu. Zadanie 23.2. Arkusz CKE chemia maj 2015 rozszerzony (1 punkt)
Manganian(VII) potasu reaguje z kwasem szczawiowym (kwasem etanodiowym HOOC–COOH) w środowisku kwasowym według następującego schematu:
MnO4– + (COOH)2 + H+ → Mn2+ + CO2 + H2O
Dobierz i uzupełnij współczynniki stechiometryczne w poniższym schemacie.![]()
Zapis wzorów sumarycznych utleniacza oraz reduktora. Zadanie 23.3. Arkusz CKE chemia maj 2015 rozszerzony (1 punkt)
Manganian(VII) potasu reaguje z kwasem szczawiowym (kwasem etanodiowym HOOC–COOH) w środowisku kwasowym według następującego schematu:
MnO4– + (COOH)2 + H+ → Mn2+ + CO2 + H2O
Napisz wzory drobin (cząsteczek lub jonów), które w opisanej przemianie pełnią funkcję utleniacza i reduktora. Utleniacz: Reduktor:
Ocena poprawności zdań dotyczących ropy naftowej, koksu oraz gazu ziemnego. Zadanie 24. Arkusz CKE chemia maj 2015 rozszerzony (1 punkt)
Oceń, czy poniższe informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, lub F – jeśli jest fałszywa.
1. Destylacja frakcjonowana ropy naftowej polega na rozdzieleniu tego surowca na grupy składników różniące się temperaturą wrzenia. 2. Produktami przerobu ropy naftowej są smoła węglowa, woda pogazowa, gaz koksowniczy i koks. 3. Gaz ziemny jest mieszaniną węglowodorów w stanie gazowym, a jego głównym składnikiem jest metan.
Zapis równań reakcji - addycji oraz substytucji prowadzących do powstania 2-bromo-2-metylobutanu. Zadanie 25. Arkusz CKE chemia maj 2015 rozszerzony (2 punkty)
Przeprowadzono doświadczenie z udziałem dwóch różnych węglowodorów. W wyniku dwóch odrębnych reakcji − jednej addycji, a drugiej substytucji − i przy użyciu odpowiednich reagentów jako główny produkt każdej reakcji otrzymano 2-bromo-2-metylobutan.
Napisz równania obu reakcji. Zastosuj wzory półstrukturalne (grupowe) związków organicznych. Równanie reakcji addycji: Równanie reakcji substytucji: