Obliczanie liczby moli reagenta użytego w reakcji równowagowej. Zadanie 12. Arkusz CKE chemia maj 2011 rozszerzony (2 punkty)
W reaktorze o objętości 1 dm3 przebiegła przemiana zgodnie z równaniem A + B ⇄ C + D. Do reakcji użyto 2 mole substancji A i nadmiar substancji B. Po ustaleniu się stanu równowagi stwierdzono, że w mieszaninie poreakcyjnej znajduje się 0,4 mola substancji A. Stała równowagi tej reakcji w temperaturze prowadzenia procesu jest równa 1.
Oblicz, ile moli substancji B użyto do tej reakcji. Wynik podaj z dokładnością do liczby całkowitej.
Ocena wpływu zmiany ciśnienia i temperatury na wydajność reakcji. Zadanie 13ab. Arkusz CKE chemia maj 2011 rozszerzony (1 punkt)
Na poniższym wykresie zilustrowano zmianę energii podczas przebiegu reakcji opisanej równaniem
A (s) + AB2 (g) ⇄ 2AB (g).
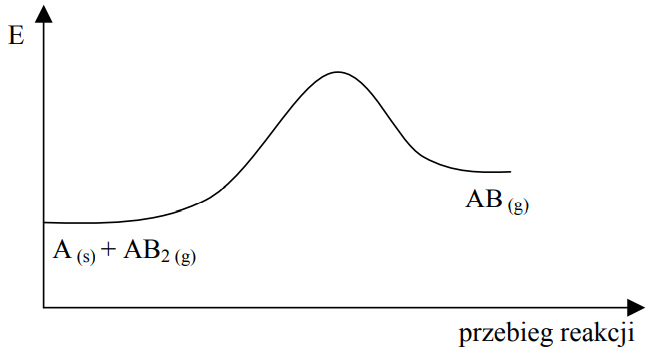
Oceń, jak zmieni się (wzrośnie czy zmaleje) wydajność reakcji otrzymywania produktu AB, jeżeli w układzie będącym w stanie równowagi nastąpi a) wzrost temperatury w warunkach izobarycznych (p = const). b) wzrost ciśnienia w warunkach izotermicznych (T = const).
Zapis równań reakcji połówkowych utleniania oraz redukcji. Zadanie 14abc. Arkusz CKE chemia maj 2011 rozszerzony (4 punkty)
Poniżej przedstawiony jest schemat reakcji:
![]()
a) Napisz w formie jonowej z uwzględnieniem liczby oddawanych lub pobieranych elektronów (zapis jonowo-elektronowy) równania procesów redukcji i utleniania zachodzących podczas tej przemiany. Równanie reakcji redukcji: Równanie reakcji utleniania: b) Dobierz i uzupełnij współczynniki stechiometryczne w poniższym schemacie. c) Napisz, jakie funkcje pełnią jony MnO42– w tej reakcji.![]()
Wskazanie lepiej rozpuszczalnego w wodzie wodorotlenku na podstawie znajomości iloczynu rozpuszczalności. Zadanie 15. Arkusz CKE chemia maj 2011 rozszerzony (1 punkt)
Rozpuszczalność substancji trudno rozpuszczalnej charakteryzują dwie wielkości:
– iloczyn rozpuszczalności (KSO), który opisuje stan równowagi między osadem trudno rozpuszczalnej substancji a stężeniem jej jonów w roztworze
– rozpuszczalność molowa (S), która wyrażona jest stężeniem molowym substancji w jej roztworze nasyconym.
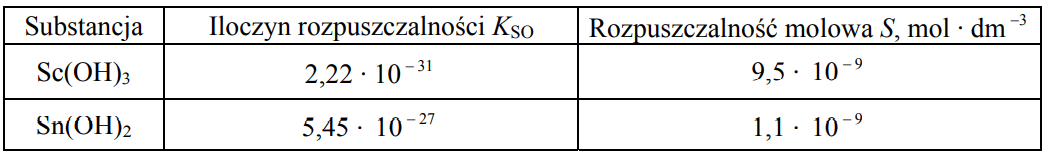
Wartości liczbowe podane są dla temperatury 25 oC.
Na podstawie: J. Sawicka, A. Janich-Kilian, W. Cejner-Mania, G. Urbańczyk, Tablice chemiczne, Gdańsk 2002
Korzystając z powyższej informacji, napisz wzór wodorotlenku, który jest lepiej rozpuszczalny w wodzie, oraz napisz, czy dokonując tego wyboru, należało porównać wartości rozpuszczalności molowych, czy też wartości iloczynów rozpuszczalności substancji. Wzór wodorotlenku: Należało porównać wartości:
Ocena poprawności zdań dotyczących ogniw chemicznych. Zadanie 16. Arkusz CKE chemia maj 2011 rozszerzony (1 punkt)
Oceń prawdziwość poniższych zdań i uzupełnij tabelę. Wpisz literę P, jeżeli uznasz zdanie za prawdziwe, lub literę F, jeżeli uznasz je za fałszywe. 1. W ogniwie zbudowanym z półogniw: Cd|Cd2+ i Sn|Sn2+ katodę stanowi półogniwo Cd| Cd2+. 2. Kationy Cu2+ wykazują większą tendencję do przyłączania elektronów niż kationy Zn2+. 3. Siła elektromotoryczna ogniwa Ag|Ag+ ||Au3+|Au jest w warunkach standardowych równa 2,32 V.
Zapis równań reakcji elektrodowych procesów przebiegających podczas elektrorafinacji. Zadanie 17. Arkusz CKE chemia maj 2011 rozszerzony (2 punkty)
Elektroliza może być prowadzona na elektrodach, które nie biorą udziału w procesach elektrodowych (np. platyna, grafit), lub na elektrodach, które ulegają roztworzeniu w procesie anodowym. Efekt roztwarzania materiału anody wykorzystywany jest do oczyszczania metali w procesie elektrorafinacji.
W celu oczyszczenia miedzi prowadzi się elektrolizę wodnego roztworu siarczanu(VI) miedzi(II) na elektrodach, z których jedną stanowi czysta miedź, a drugą miedź zanieczyszczona. Podczas tego procesu miedź i metale o niższym standardowym potencjale redukcji niż miedź ulegają na anodzie utlenieniu, natomiast na katodzie osadza się czysta miedź. Płyta miedziana zawierająca ok. 98% miedzi zanieczyszczona jest niklem. W celu uzyskania czystej miedzi płytę poddano elektrorafinacji.
Korzystając z powyżej informacji, napisz równania wszystkich reakcji, zachodzących na elektrodach podczas elektrorafinacji. Anoda: Katoda:
Wskazanie bieguna z jakim połączona jest elektroda, której masa wzrasta. Zadanie 18. Arkusz CKE chemia maj 2011 rozszerzony (1 punkt)
Elektroliza może być prowadzona na elektrodach, które nie biorą udziału w procesach elektrodowych (np. platyna, grafit), lub na elektrodach, które ulegają roztworzeniu w procesie anodowym. Efekt roztwarzania materiału anody wykorzystywany jest do oczyszczania metali w procesie elektrorafinacji.
Napisz, z jakim biegunem (dodatnim czy ujemnym) źródła prądu stałego połączona jest ta elektroda, której masa wzrasta podczas procesu elektrorafinacji.
Obliczanie stałej szybkości reakcji chemicznej. Zadanie 19a. Arkusz CKE chemia maj 2011 rozszerzony (1 punkt)
Reakcja A + 2B ⇄ C przebiega w temperaturze T według równania kinetycznego v = k·CA·CB2 . Początkowe stężenie substancji A było równe 2 mol·dm−3 , a substancji B było równe 3 mol·dm−3 . Szybkość początkowa tej reakcji była równa 5,4 mol·dm−3 · s−1 .
Oblicz stałą szybkości reakcji w temperaturze T, wiedząc, że dla reakcji przebiegającej według równania kinetycznego v = k·CA·CB2 stała szybkości k ma jednostkę: mol−2 · dm6 · s−1 .
Obliczanie szybkości reakcji w momencie przereagowania określonej ilości substratu. Zadanie 19b. Arkusz CKE chemia maj 2011 rozszerzony (2 punkty)
Reakcja A + 2B ⇄ C przebiega w temperaturze T według równania kinetycznego v = k·CA·CB2 . Początkowe stężenie substancji A było równe 2 mol·dm−3 , a substancji B było równe 3 mol·dm−3 . Szybkość początkowa tej reakcji była równa 5,4 mol·dm−3 · s−1 .
Korzystając z powyższych informacji, oblicz szybkość reakcji w momencie, gdy przereaguje 60% substancji A. Wynik podaj z dokładnością do czwartego miejsca po przecinku.
Zapis równań reakcji chemicznych na podstawie schematu ciągu przemian. Zadanie 20. Arkusz CKE chemia maj 2011 rozszerzony (2 punkty)
W laboratorium chemicznym alkany można otrzymać kilkoma sposobami, między innymi w reakcji halogenków alkilów z sodem przeprowadzonej w podwyższonej temperaturze. Przemiana ta prowadzi do wydłużenia łańcucha węglowego. Charakterystycznymi dla alkanów są przemiany z substancjami niepolarnymi. Taką reakcją jest podstawienie, np. atomu chloru w miejsce atomu wodoru, przebiegające pod wpływem światła lub ogrzania. Powstająca w tej przemianie monochloropochodna może – w podwyższonej temperaturze i w alkoholowym roztworze wodorotlenku potasu – ulegać reakcji eliminacji, tworząc związek nienasycony. Powstały alken przyłącza wodę w obecności kwasu siarkowego(VI), dając alkohol.
Opisane przemiany można przedstawić poniższym schematem.
![]()
Napisz, stosując wzory półstrukturalne (grupowe) związków organicznych, równania reakcji oznaczonych na podanym schemacie numerami 1, 3. Skorzystaj z informacji i w równaniach reakcji (nad strzałkami) napisz warunki, w jakich zachodzą te przemiany. Równania reakcji: 1.: 3.:
Wskazanie mechanizmu reakcji oraz rolę jaką pełni opisany reagent. Zadanie 21ab. Arkusz CKE chemia maj 2011 rozszerzony (2 punkty)
W laboratorium chemicznym alkany można otrzymać kilkoma sposobami, między innymi w reakcji halogenków alkilów z sodem przeprowadzonej w podwyższonej temperaturze. Przemiana ta prowadzi do wydłużenia łańcucha węglowego. Charakterystycznymi dla alkanów są przemiany z substancjami niepolarnymi. Taką reakcją jest podstawienie, np. atomu chloru w miejsce atomu wodoru, przebiegające pod wpływem światła lub ogrzania. Powstająca w tej przemianie monochloropochodna może – w podwyższonej temperaturze i w alkoholowym roztworze wodorotlenku potasu – ulegać reakcji eliminacji, tworząc związek nienasycony. Powstały alken przyłącza wodę w obecności kwasu siarkowego(VI), dając alkohol.
Opisane przemiany można przedstawić poniższym schematem.
![]()
a) Określ, według jakiego mechanizmu: elektrofilowego, nukleofilowego czy rodnikowego przebiega reakcja oznaczona na schemacie numerem 2. b) Określ, czy nieorganiczny reagent reakcji oznaczonej na schemacie numerem 4 jest czynnikiem elektrofilowym, czy nukleofilowym.
Wskazanie liczby wiązań sigma oraz pi w cząsteczce. Zadanie 22. Arkusz CKE chemia maj 2011 rozszerzony (1 punkt)
Podaj liczbę wszystkich wiązań σ i wiązańπ w cząsteczce związku organicznego o wzorze: CH≡CCHO Liczba wiązań σ: Liczba wiązań π:
Rysowanie wzoru grupowego alkenu oraz kwasów będących produktami jego utleniania. Zadanie 23ab. Arkusz CKE chemia maj 2011 rozszerzony (2 punkty)
Jedną z ogólnych metod określania struktury związku jest degradacja – rozpad cząsteczki związku o nieznanej strukturze na kilka mniejszych cząsteczek, łatwiejszych do zidentyfikowania. Metoda ta jest wykorzystywana do określania położenia podwójnego wiązania w cząsteczkach alkenów. Stosowane jest wówczas ich utlenianie, np. za pomocą roztworu KMnO4, prowadzone w środowisku kwasowym. Podczas tej reakcji, w zależności od budowy cząsteczki alkenu, mogą powstać kwasy karboksylowe, ketony lub tlenek węgla(IV).
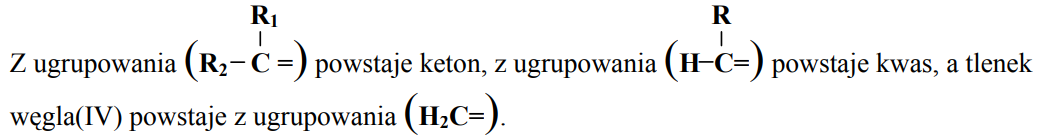
Pewien alken utleniany nadmiarem KMnO4 w środowisku kwasowym daje dwa różne kwasy karboksylowe, zaś w reakcji 1 mola tego alkenu z 1 molem wodoru powstaje n-heksan. a) Napisz wzór półstrukturalny (grupowy) tego alkenu. b) Podaj nazwy systematyczne dwóch kwasów karboksylowych powstałych podczas utleniania tego alkenu. 1. 2.
Zapis obserwacji pozwalających na odróżnienie związków chemicznych. Zadanie 24. Arkusz CKE chemia maj 2011 rozszerzony (1 punkt)
Jedną z ogólnych metod określania struktury związku jest degradacja – rozpad cząsteczki związku o nieznanej strukturze na kilka mniejszych cząsteczek, łatwiejszych do zidentyfikowania. Metoda ta jest wykorzystywana do określania położenia podwójnego wiązania w cząsteczkach alkenów. Stosowane jest wówczas ich utlenianie, np. za pomocą roztworu KMnO4, prowadzone w środowisku kwasowym. Podczas tej reakcji, w zależności od budowy cząsteczki alkenu, mogą powstać kwasy karboksylowe, ketony lub tlenek węgla(IV).
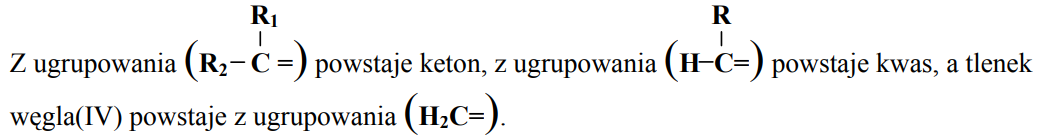
W dwóch nieoznakowanych kolbach znajdowały się dwa alkeny (każdy w innym naczyniu). Wiadomo, że jednym związkiem był 2-metyloprop-1-en, a drugim but-2-en. W celu odróżnienia 2-metyloprop-1-enu od but-2-enu przeprowadzono doświadczenie, podczas którego do obu naczyń dodano zakwaszony, wodny roztwór KMnO4.
Korzystając z powyższych informacji, wymień po jednej obserwacji, która pozwoli na odróżnienie obu związków. Uzupełnij poniższą tabelę.
Rysowanie wzorów merów powstałych w wyniku polimeryzacji buta-1,3-dienu. Zadanie 25. Arkusz CKE chemia maj 2011 rozszerzony (2 punkty)
Buta-1,3-dien to związek o wzorze CH2=CH–CH=CH2. Jest on produktem wyjściowym do otrzymywania kauczuku syntetycznego. Polimeryzacja buta-1,3-dienu może przebiegać w położeniach 1, 4 lub 1, 2. W pierwszym przypadku powstają makrocząsteczki o nienasyconych łańcuchach liniowych, w drugim przypadku łańcuch główny polimeru nie zawiera podwójnych wiązań, natomiast występują one w łańcuchach bocznych
Napisz wzory merów obu polimerów, powstających w reakcji polimeryzacji buta-1,3-dienu, wiedząc, że mer to najmniejszy, powtarzający się fragment budowy łańcucha polimeru.