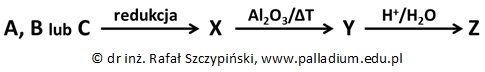Określanie wzoru rzeczywistego związku organicznego na podstawie przeprowadzonego doświadczenia
Dane są trzy izomeryczne związki chemiczne A, B i C zawierające grupę karbonylową, a ich wodne roztwory mają odczyn obojętny. Próbkę każdego z nich o masie równej 7,2 g spalono w nadmiarze tlenu. Po skropleniu uzyskanej pary wodnej, pozostałą mieszaninę gazów o objętości 11,02 dm3 przepuszczono przez płuczkę zawierającą nadmiar wodnego roztworu wodorotlenku potasu. Objętość gazu opuszczającego płuczkę wyniosła 2,06 dm3, a masa skroplonej pary wodnej była taka sama, jak masa próbki poddanej spaleniu. Objętości wszystkich gazów odmierzono w warunkach normalnych.
Określ, prowadząc stosowne obliczenia wzór rzeczywisty spalonego związku organicznego, jeśli wiadomo, że jest taki sam jak jego wzór empiryczny. Rozwiązanie tego zadania dostępne jest nieodpłatnie pod poniższym linkiem: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie wzoru półstrukturalnego oraz nazwy związku organicznego (izomeria optyczna)
Pewien występujący w postaci enancjomerów nasycony, alifatyczny keton łańcuchowy A poddano redukcji wodorem. Produkt B tej reakcji odwodniono w obecności tlenku glinu i uzyskano równomolową mieszaninę alkenów C i D. Związek C występuje jako para izomerów geometrycznych, natomiast związek D – enancjomerów. Centrum chiralności związku D jest ten sam atom węgla, co w wyjściowym ketonie A. Głównymi produktami addycji wody do związków chemicznych C i D są alkohole o najwyższej rzędowości.
Wiedząc, że produktem addycji wodoru do alkenów jest 2,4-dimetyloheksan, podaj wzór półstrukturalny oraz nazwę systematyczną związku chemicznego A. Zapisz numer lokantu, którym opisany jest asymetryczny atom węgla w jego cząsteczce. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zapis równania procesu utleniania aldehydu cynamonowego do kwasu cynamonowego
Charakterystyczny zapach olejku cynamonowego zawdzięcza się występowaniu w nim oleistej cieczy zwanej aldehydem cynamonowym. Wzór półstrukturalny cząsteczki tego związku chemicznego można przedstawić w postaci:
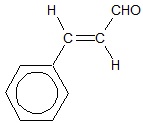
Aldehyd cynamonowy w środowisku kwasowym, w sposób katalityczny można przekształcić w kwas cynamonowy. Napisz, stosując bilans jonowo-elektronowy oraz grupowe wzory związków organicznych równanie połówkowe opisanego procesu utleniania. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Ocena poprawności tezy dotyczącej odróżnienia etanalu od butanonu na drodze próby jodoformowej
Sformułowano tezę:
Próba jodoformowa może być zastosowana, w celu odróżnienia etanalu od butanonu, ponieważ butanon jest tzw. metyloketonen – związkiem chemicznym zawierającym grupę karbonylową, której atom węgla połączony jest z grupą metylową.
Oceń poprawność sformułowanej tezy podkreślając odpowiednie słowo w nawiasie. Uzasadnij swój wybór. Przedstawiona teza jest (prawidłowa / nieprawidłowa), ponieważ: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Ocena poprawności stwierdzeń dotyczących struktury cząsteczek progesteronu oraz dydrogesteronu i reaktywności (izomeria optyczna)
Progesteron jest żeńskim hormonem płciowym, który umożliwia implantację zarodka w błonie śluzowej macicy. W celu podtrzymania ciąży (w przypadku niedoboru progesteronu) stosuje się lek o nazwie handlowej Duphaston, zawierający dydrogesteron, który jest pochodną progesteronu. Wzory chemiczne cząsteczek obu tych związków chemicznych przedstawiono na rysunkach poniżej.
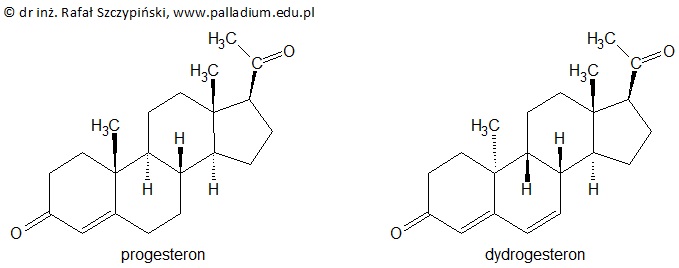
Dokonaj analizy wzorów cząsteczek progesteronu oraz dydrogesteronu, a następnie oceń poprawność poniższych zdań wpisując literę „P” (prawda) lub literę „F” (fałsz). 1. W cząsteczce progesteronu znajdują się trzy wiązania π, natomiast dydrogesteron ma cztery takie wiązania. 2. Każda z przedstawionych cząsteczek ma sześć asymetrycznych atomów węgla. 3. Progesteron oraz dydrogesteron są względem siebie diastereoizomerami. 4. W odpowiednich warunkach dydrogesteron może ulegać próbie jodoformowej. 5. W wyniku całkowitej hydrogenacji każdego z przedstawionych związków chemicznych otrzymuje się alkohole I-rzędowe. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zapis równania reakcji chemicznej ze świeżo strąconym osadem wodorotlenku miedzi(II) w środowisku zasadowym (próba Trommera)
W wyniku termicznego odwodnienia glicerolu wobec stężonego kwasu siarkowego(VI) powstaje związek chemiczny, którego cząsteczki mają budowę płaską. Substancja ta ogrzewana ze świeżo przygotowaną alkaliczną zawiesiną wodorotlenku miedzi(II) powoduje pojawienie się ceglastego osadu.
Napisz w formie jonowej skróconej równanie reakcji chemicznej, prowadzącej do pojawienia się ceglastego osadu. Zastosuj grupowe wzory związków organicznych, pamiętając, że proces ten biegnie w środowisku zasadowym. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone