Wskazanie wzorów związków chemicznych których roztwory po zmieszaniu utworzą roztwór buforowy. Zadanie 28.1. Informator CKE chemia 2023 rozszerzony (1 punkt)
Roztwory zawierające porównywalne liczby drobin kwasu Brønsteda i sprzężonej z nim zasady nazywane są roztworami buforowymi. Przykładem buforu może być mieszanina roztworu octanu sodu i roztworu kwasu octowego. W takim roztworze ustala się równowaga chemiczna:
HA + H2O ⇄ H3O+ + A–
opisywana przez stałą dysocjacji kwasu HA.
Ponieważ
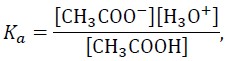
to pH buforu octanowego można z pewnym przybliżeniem obliczyć ze wzoru:
![]()
Wartość pH buforu prawie nie zależy od jego stężenia i nieznacznie się zmienia podczas dodawania niewielkich ilości mocnych kwasów lub mocnych zasad.
Zaznacz wzory dwóch związków chemicznych, których roztwory po zmieszaniu w odpowiednim stosunku pozwolą uzyskać roztwór buforowy.
HCl NaOH NH4Cl NaCl