Obliczanie pH roztworu buforowego. Zadanie 28.2. Informator CKE chemia 2023 rozszerzony (2 punkty)
Roztwory zawierające porównywalne liczby drobin kwasu Brønsteda i sprzężonej z nim zasady nazywane są roztworami buforowymi. Przykładem buforu może być mieszanina roztworu octanu sodu i roztworu kwasu octowego. W takim roztworze ustala się równowaga chemiczna:
HA + H2O ⇄ H3O+ + A–
opisywana przez stałą dysocjacji kwasu HA.
Ponieważ
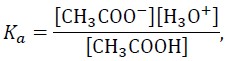
to pH buforu octanowego można z pewnym przybliżeniem obliczyć ze wzoru:
![]()
Wartość pH buforu prawie nie zależy od jego stężenia i nieznacznie się zmienia podczas dodawania niewielkich ilości mocnych kwasów lub mocnych zasad.
Zmieszano 100 cm3 roztworu octanu sodu o stężeniu 0,875 mol∙dm–3 i 400 cm3 roztworu kwasu octowego o stężeniu 0,125 mol∙dm–3. Uzyskano 500 cm3 roztworu w temperaturze 298 K.
Oblicz pH uzyskanego roztworu buforowego.