Wskazanie pary związków chemicznych, których wodne roztwory po zmieszaniu utworzą roztwór buforowy (bufory)
Roztwory buforowe są układami złożonymi:
– ze słabego kwasu (HA) i jego soli (anion A–) pochodzącej od mocnej zasady, przy czym przyjmuje się, że stężenie jonu A– jest wówczas równe stężeniu soli,
– ze słabej zasady (B) i jej soli (kation BH+) pochodzącej od mocnego kwasu, przy czym przyjmuje się, że stężenie jonu BH+ jest wówczas równe stężeniu soli.
Dla opisanych układów buforowych istnieją zależności:
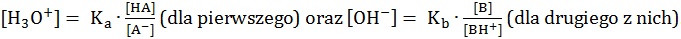
Rola bufora sprowadza się do utrzymania względnie stałego pH roztworu.
Na podstawie: P. W. Atkins, Chemia fizyczna, Warszawa 2012.
Poniżej znajdują się ułożone parami, wodne roztwory wybranych związków chemicznych.
Podkreśl tę parę, której roztwory po zmieszaniu ze sobą w odpowiednich proporcjach utworzą roztwór buforowy i wskaż w powstałym układzie kwas oraz sprzężoną z nim zasadę Brønsteda. 1) CH3COOH oraz KOH 2) NH4Br oraz HBr 3) KCl oraz HCl © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone